题目内容
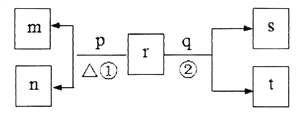
【题目】下列各组物质,不能按 ![]() (“―→”表示反应一步完成)关系转化的是( )
(“―→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
【答案】C
【解析】
A.氧化铝和氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠溶液中通入二氧化碳生成氢氧化铝沉淀,氢氧化铝受热分解生成氧化铝,故A正确;B.氯化铝溶液中加入氨水生成氢氧化铝沉淀,氢氧化铝溶于氢氧化钠溶液生成偏铝酸钠,偏铝酸钠溶液中加入过量盐酸生成氯化铝溶液,故B正确;C.铝不能一步生成氢氧化铝,故C错误;D.氯化镁溶液中加入氢氧化钠溶液生成氢氧化镁沉淀,氢氧化钠受热分解生成氧化镁,氧化镁和盐酸反应生成氯化镁溶液,故D正确;答案为C。

练习册系列答案
相关题目