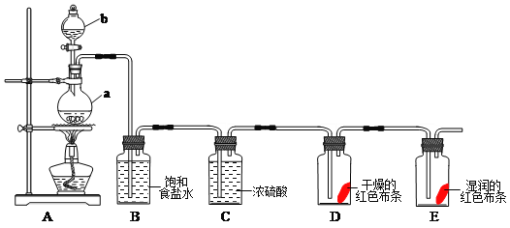
题目内容
【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | H2S |
电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,
氢氟酸电离的热化学方程式为________________________。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH-) C.![]() D.
D.![]()
(3)向Na2CO3溶液通入过量H2S,反应的离子方程式为______________。
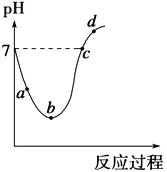
(4)25℃时,在20mL 0.1mol/L氢氟酸中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____________。
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中, c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)< c(Na+)=0.1mol/L
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验证明之:_______________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,每生成1mol HF转移________mol电子。
(7)已知BiCl3水解产物中有 BiOCl生成。写出水解反应方程式___________________________,为防止其水解,如何配制 BiCl3溶液?_________________________________________________。
【答案】 HF(aq) ![]() H+(aq) +F—(aq) △H=-10.4KJ·mol—1 CD H2S+CO32-==HCO3-+HS- BC 在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅(或其他答案) 1 BiCl3+H2O
H+(aq) +F—(aq) △H=-10.4KJ·mol—1 CD H2S+CO32-==HCO3-+HS- BC 在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅(或其他答案) 1 BiCl3+H2O![]() BiOCl+2HCl 将适量的BiCl3固体溶于少量浓盐酸,再加水稀释
BiOCl+2HCl 将适量的BiCl3固体溶于少量浓盐酸,再加水稀释
【解析】试题分析:由题中数据可知,在相同条件下,各酸的酸性由强到弱的顺序是HF> H2CO3> H2S > HCO3->HS-。
(1)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ/mol,②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol ,由①-②得氢氟酸电离的热化学方程式为HF(aq) ![]() H+(aq) +F—(aq) △H=-10.4KJ·mol—1。
H+(aq) +F—(aq) △H=-10.4KJ·mol—1。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),溶液的酸性减弱, c(H+)减小,水的离子积c(H+)·c(OH-) 不变, ![]() 增大,
增大,![]() 增大,综上所述,各量增大的是CD。
增大,综上所述,各量增大的是CD。
(3)因为酸性H2CO3> H2S > HCO3->HS-,向Na2CO3溶液通入过量H2S,反应的离子方程式为H2S+CO32-==HCO3-+HS-。
(4)25℃时,在20mL 0.1mol/L氢氟酸中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,A. pH=3的HF溶液中水的电离受到酸的抑制,而pH=11的NaF溶液中水的电离程度因盐的水解得到促进,所以,两者由水电离出的c(OH-)不相等,A不正确;B.①点时pH=6,此时溶液中, c(F-)-c(Na+)=c(H+) -c(OH-)=10-6-10-8=9.9×10-7mol/L ,B正确;C.②点时pH=7,c(H+) =c(OH-),由电荷守恒可知,溶液中的c(F-)=c(Na+),C正确;D.③点时V=20mL,酸和碱恰好中和得到氟化钠溶液,氟离子水解,此时溶液中c(F-)< c(Na+)=0.05mol/L,D不正确。综上所述,说法正确的是BC。
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,只要设法让其水解平衡逆向移动即可证明,所以,可以设计如下简单的实验证明之:在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,则A为H2O2,HFO中O的化合价由0变为-1(HFO中H为+1价、F为-1价),所以,每生成1mol HF转移1mol电子。
(7)已知BiCl3水解产物中有 BiOCl生成,所以,其水解反应的化学方程式为BiCl3+H2O![]() BiOCl+2HCl。为防止其水解,配制 BiCl3溶液时,将适量的BiCl3固体溶于少量浓盐酸,再加水稀释。
BiOCl+2HCl。为防止其水解,配制 BiCl3溶液时,将适量的BiCl3固体溶于少量浓盐酸,再加水稀释。

 智慧小复习系列答案
智慧小复习系列答案【题目】随着工农业发展,NH4Cl的需求显著降低,价格低迷和产品积压导致利用“侯氏制碱法”生产的碱厂出现亏损。新联合制碱法在此基础上将氯元素转化为更有应用价值的HCl。

(1)气体X是__________。
(2)已知25℃时部分物质的溶解度数据:
物质 | NaCl | NaHCO3 | NH4Cl | NH4HCO3 |
溶解度/g | 36.0 | 10.3 | 39.5 | 24.8 |
结合表中数据说明过程Ⅰ中的反应能发生的原因是______________。
(3)过程Ⅰ获得的NaHCO3会吸附微量NH4Cl,导致产品Na2CO3中混有NaCl。
①用化学方程式表示过程Ⅱ中NaCl生成的原因:_____________。
②检验Na2CO3中NaCl的实验操作是,取少量固体于试管中_____________。
(4)过程Ⅲ以MgO为催化剂,在不同温度下加热灼烧,将NH4Cl分解为NH3和HCl。

①步骤i中反应的化学方程式是____________。
②过程Ⅲ的优点是_____________。