题目内容
【题目】25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
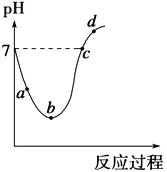
A. 实验进程中水的电离程度:a>c>b
B. 向a点所示溶液中通入SO2,溶液的pH减小,漂白性增强
C. c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
【答案】C
【解析】试题分析:由图像可知,向水中通入氯气到b点为饱和氯水,然后向饱和氯水中加入氢氧化钠。A. a点是氯气的不饱和溶液,水的电离受到盐酸和次氯酸的抑制;b点为饱和氯水,水的电离受到盐酸和次氯酸的抑制程度更大;c点是氯化钠、次氯酸钠和次氯酸的混合液,次氯酸钠的水解促进水的电离,次氯酸的电离抑制水的电离,因为pH=7,说明次氯酸钠的水解促进水的电离作用和次氯酸的电离作用相同,所以,实验进程中水的电离程度为c>a>b,A不正确;B. 向a点所示溶液中通入SO2,氯气可以把二氧化硫氧化为硫酸,所以,溶液的pH减小,但是漂白性减弱,B不正确;C. 由电荷守恒可知,c(H+)+c(Na+)=2c(ClO-)+c(HClO)+ c(OH-),因为c点所示溶液pH=7,故c(Na+)=2c(ClO-)+c(HClO),C正确;D. 因为d点所示的溶液中ClO-会有一小部分发生水解,所以,c(Na+)>c(Cl-) >c(ClO-)>c(HClO),D不正确。本题选C。

【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | H2S |
电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,
氢氟酸电离的热化学方程式为________________________。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH-) C.![]() D.
D.![]()
(3)向Na2CO3溶液通入过量H2S,反应的离子方程式为______________。
(4)25℃时,在20mL 0.1mol/L氢氟酸中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____________。
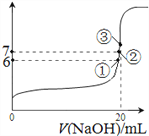
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中, c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)< c(Na+)=0.1mol/L
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验证明之:_______________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,每生成1mol HF转移________mol电子。
(7)已知BiCl3水解产物中有 BiOCl生成。写出水解反应方程式___________________________,为防止其水解,如何配制 BiCl3溶液?_________________________________________________。