题目内容
【题目】按以下装置图进行实验,填写有关现象及化学方程式。

(1)A中现象是____________________,
(2)B中浓硫酸的作用是_______________
(3)C中发生反应的化学方程式为______________,
(4)D中现象是_______________;反应的离子方程式是__________________________,
E中收集的气体是____________。
【答案】固体质量减轻、试管内壁有无色液滴除去二氧化碳中水蒸气或干燥气体或吸收水蒸汽2Na2O2+2CO2=2Na2CO3+O2澄清石灰水变浑浊CO2 + Ca2+ +2OH-=CaCO3↓ + H2O氧气/O2
【解析】
碳酸氢钠受热分解生成碳酸钠和水和二氧化碳,浓硫酸吸收水蒸气,过氧化钠和二氧化碳反应生成碳酸钠和氧气,澄清石灰水吸收剩余的二氧化碳,最后用排水收集氧气。
(1)A中碳酸氢钠受热分解生成碳酸钠和水和二氧化碳,所以现象为固体质量减轻、试管内壁有无色液滴;(2)浓硫酸的作用是除去二氧化碳中水蒸气或干燥气体或吸收水蒸汽;(3).过氧化钠和二氧化碳反应生成碳酸钠和氧气,方程式为 2Na2O2+2CO2=2Na2CO3+O2 ; (4) 澄清石灰水吸收二氧化碳,溶液变浑浊;氢氧化钙和二氧化碳反应生成碳酸钙和水,离子方程式为:CO2 + Ca2+ +2OH-=CaCO3↓ + H2O; (6)E中收集的气体为氧气。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | H2S |
电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,
氢氟酸电离的热化学方程式为________________________。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH-) C.![]() D.
D.![]()
(3)向Na2CO3溶液通入过量H2S,反应的离子方程式为______________。
(4)25℃时,在20mL 0.1mol/L氢氟酸中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____________。
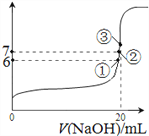
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中, c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)< c(Na+)=0.1mol/L
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验证明之:_______________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,每生成1mol HF转移________mol电子。
(7)已知BiCl3水解产物中有 BiOCl生成。写出水解反应方程式___________________________,为防止其水解,如何配制 BiCl3溶液?_________________________________________________。
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D




