题目内容
【题目】Ⅰ.能量之间可相互转化:电解食盐水制备氯气是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
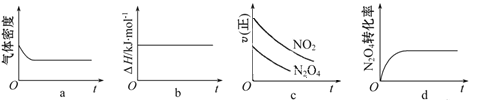
限选材料:ZnSO4(aq),FeSO4 (aq),CuSO4 (aq);铜片,铁片,锌片和导线
(1)完成原电池甲的装置示意图,并作相应的标注。要求:在同一烧杯中,电极与溶液含相同的金属元素。_____________
(2)以铜片为电极之一,硫酸铜溶液为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极________________
(3)甲乙两种原电池中可更有效地将化学能转化为电能的是____________,其原因是_________________________
(4)根据牺牲阳极的阴极保护法原理,为了减缓电解质溶液中铁片的腐蚀,在上述的材料中应选__________作阳极。
Ⅱ. CO与H2反应还可制备C2H5OH,C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
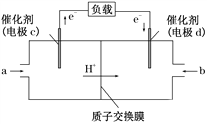
电池总反应为C2H5OH+3O2===2CO2+3H2O,则d电极是________(填“正极”或“负极”),c电极的反应方程式为_______________________________。若线路中转移2 mol电子,则上述燃料电池,消耗的O2在标况下的体积为______ L。
【答案】 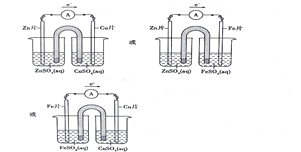 有红色固体生成,负极被腐蚀 甲 电池乙负极可与CuSO4溶液直接发生反应,导致部分化学能转化为热能;电池甲的负极不与所接触的电解质溶液反应,化学能在转化为电能时损耗较小 锌片 正极 C2H5OH +3H2O-12e- =2CO2 +12H+ 11.2
有红色固体生成,负极被腐蚀 甲 电池乙负极可与CuSO4溶液直接发生反应,导致部分化学能转化为热能;电池甲的负极不与所接触的电解质溶液反应,化学能在转化为电能时损耗较小 锌片 正极 C2H5OH +3H2O-12e- =2CO2 +12H+ 11.2
【解析】(1)①根据题给条件和原电池的构成条件可得:a.若用Zn、Cu、CuSO4(aq)、ZnSO4(aq)组成原电池,Zn作负极,Cu作正极,Zn插入到ZnSO4(aq)中,Cu插入到CuSO4(aq)中。b.若用Fe、Cu、FeSO4(aq)、CuSO4(aq)组成原电池,Fe作负极,Cu作正极,Fe插入到FeSO4(aq)中,Cu插入到CuSO4(aq)中。c.若用Zn、Fe、FeSO4(aq)、ZnSO4(aq)组成原电池,Zn作负极,Fe作正极,Zn插入到ZnSO4(aq)中,Fe插入到FeSO4(aq)中。
(2)由于金属活动性Zn>Fe>Cu,锌片或铁片作负极,由于Zn或Fe直接与CuSO4溶液接触,工作一段时间后,负极逐渐溶解,表面有红色固体析出。
(3)带有盐桥的甲原电池中负极没有和CuSO4溶液直接接触,二者不会直接发生置换反应,化学能不会转化为热能,几乎全部转化为电能;而原电池乙中的负极与CuSO4溶液直接接触,两者会发生置换反应,部分化学能转化为热能,化学能不可能全部转化为电能。
(4)由牺牲阳极的阴极保护法可得,铁片作正极(阴极)时被保护,作负极(阳极)时被腐蚀,所以应选择比铁片更活泼的锌作负极(阳极)才能有效地保护铁不被腐蚀。
Ⅱ.由图可知,d电极是电子流入的电极,所以是电池的正极。电池的正极反应一定为O2 + 4e- + 4H+ = 2H2O,用总反应减去正极反应(计算时将正极扩大3倍)得到负极反应为:C2H5OH +3H2O-12e- =2CO2 +12H+。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案【题目】参考下列图表和有关要求回答问题:
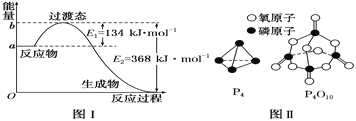
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O===O | P===O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1