题目内容
【题目】化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_______性,原因是___________________________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于________;
(3)已知在H2S溶液中存在下列平衡:H2SHS﹣+H+①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向________移动,(填“左”或“右”)c(H+)________.(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向________移动,(填“左”或“右”)c(S2﹣)________.(填“增大”、“减小”或“不变”)
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为m2 . 则m1________m2 . (选填“<”、“=”、“>”)

(5)难溶电解质在水溶液中存在溶解平衡, 某MgSO4溶液里c(Mg2+)=0.002molL﹣1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10﹣11)
(6)常温下,在NH4Cl溶液中离子浓度由大到小的顺序为________.
【答案】 碱性; CO32﹣+H2OHCO3﹣+OH﹣ 4 右 减小 左 增大 B < 10 c(Cl-)>c(NH4+)>c(H+)>c(OH-)
【解析】(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈碱性,原因是 CO32﹣水解,CO32﹣+H2OHCO3﹣+OH﹣;(2)在常温下将pH=2的盐酸10mL加水稀释到1L,c(H+)=10-2mol·L-1×0.01L/1L=10-4mol·L-1,则稀释后的溶液的pH值等于-lg10-4=4;(3)①向H2S溶液中加入NaOH固体时,氢离子的浓度减小,电离平衡向右移动;②向H2S溶液中加入NaHS固体时,硫氢根离子浓度变大,H2S![]() HS-+H+电离平衡向左移动,硫氢根离子的电离,c(S2-)增大;(4)由于醋酸是弱电解质,与Zn反应时,末电离的醋酸不断电离出H+,pH变化较缓慢,B曲线是醋酸溶液的pH变化曲线。由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时,醋酸电离平衡正向移动,补充反应的氢离子,醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2。(5)0.002mol·L-1MgSO4溶液中c(Mg2+)=0.002mol·L-1,沉淀平衡时c(OH-)=
HS-+H+电离平衡向左移动,硫氢根离子的电离,c(S2-)增大;(4)由于醋酸是弱电解质,与Zn反应时,末电离的醋酸不断电离出H+,pH变化较缓慢,B曲线是醋酸溶液的pH变化曲线。由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时,醋酸电离平衡正向移动,补充反应的氢离子,醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2。(5)0.002mol·L-1MgSO4溶液中c(Mg2+)=0.002mol·L-1,沉淀平衡时c(OH-)=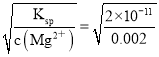 mol·L-1=10-4 mol·L-1,则c(H+)=10-10 mol·L-1,所以溶液的pH=-lgc(H+)=10,故应调整溶液pH大于10。(6)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(OH-)<c(H+),溶液中存在电荷守恒,根据电荷守恒得c(NH4+)+cH+)=c(Cl-)+c(OH-),所以得c(NH4+)<c(Cl-),铵根离子水解程度较小,所以常温下,在NH4Cl溶液中离子浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。
mol·L-1=10-4 mol·L-1,则c(H+)=10-10 mol·L-1,所以溶液的pH=-lgc(H+)=10,故应调整溶液pH大于10。(6)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(OH-)<c(H+),溶液中存在电荷守恒,根据电荷守恒得c(NH4+)+cH+)=c(Cl-)+c(OH-),所以得c(NH4+)<c(Cl-),铵根离子水解程度较小,所以常温下,在NH4Cl溶液中离子浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】根据题意解答
(1)恒温,容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示(已知:2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1),请回答下列问题: 
①写出能表示硫的燃烧热的热化学方程式: .
②在相同条件下,充入1mol SO3和0.5mol 的O2 , 则达到平衡时SO3的转化率为;此时该反应(填“放出”或“吸收”)KJ的能量.
(2)①CO2可转化成有机物实现碳循环,在体积为1L的密闭容器中,充入1molCO2和3molH2 , 一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=molL﹣1min﹣1 . 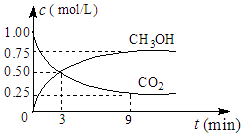
②能说明上述反应达到平衡状态的是(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2 , 同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)CH3OH(g)的平衡常数.下列说法正确的是
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10﹣2 | 2.4×10﹣4 | 1×10﹣5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2 , 达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.