题目内容
【题目】参考下列图表和有关要求回答问题:
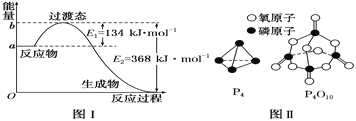
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O===O | P===O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1
【答案】 减小 不变 NO2(g) +CO(g)==NO(g) +CO2(g) △H=-234kJ·mol-1 CH3OH(g) +3/2O2(g)= CO2(g) +2H2O(l) △H=-764.7kJ·mol-1 138
【解析】(1)加入催化剂会降低反应活化能,使最高点的能量降低,所以E2减小。因为反应物和生成物的能量不变,所以焓变不会变化。根据图像可以得到反应的焓变△H=-(368-134)=-234kJ·mol-1,所以方程式为NO2(g) +CO(g)==NO(g) +CO2(g) △H=-234kJ·mol-1;
(2)将反应进行如下计算:②×3-①×2+③×2即得:CH3OH(g) +3/2O2(g)= CO2(g) +2H2O(l) △H=-764.7kJ·mol-1;
(3)1mol P4和5mol O2燃烧生成1mol P4O10放出的热量为1194kJ,即生成物成键放出的热量比反应物断键吸收的热量多出1194kJ,得到360×12+4X-(198×6+498×5)=1194。

 阅读快车系列答案
阅读快车系列答案【题目】将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-![]() 2Fe2++I2的是
2Fe2++I2的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①和③ B.②和④ C.③和④ D.①和②