题目内容
【题目】肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g) =N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g) = N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式______________;
(2)上述反应中氧化剂是______________。
(3)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4 (g) ![]() 2NO2 (g)
2NO2 (g)
① 上述反应的ΔH_________0(选填“>”或“<”)。
② 保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,再次达到平衡时,混合气体中NO2的体积分数_______(填“增大”、“ 减小”或“不变”),混合气体的颜色_______(填“变深”或“变浅”)。
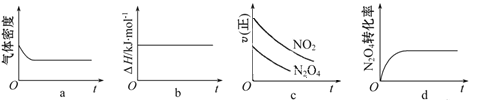
③一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是___________。
④若在相同温度下,上述反应改在体积为10L的恒容密闭容器中进行,反应3s后NO2的物质的量为0.6mol,则0-3s内的平均反应速率v(N2O4)=___________ mol·L-1·s-1。
【答案】 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)ΔH=-1048.9kJ/mol N2O4 > 减小 变深 ad 0.01
【解析】(1)肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气,将方程式②×2-①得肼和N2H4反应的热化学方程式,2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol,故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol;
(2)根据(1)中反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)可知,N2O4中的氮元素从+4价变为0价,所以N2O4是氧化剂,故答案为:N2O4;
(3)①升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应即△H>0,故答案为:>;
②保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,相对于成比例增大反应物,即增大压强平衡向气体体积减小的方向移动即逆反应方向,所以NO2的体积分数减小,但二氧化氮的浓度仍然增大,则混合气体的颜色变深,故答案为:减小;变深;
③a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;c、根据图像,正反应速率还在减小,则说明未达到平衡状态,故c错误;d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;故选ad;
④v(NO2)=v(NO2)= ![]() =
=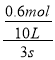 =0.02mol/Ls,则v(N2O4)=
=0.02mol/Ls,则v(N2O4)= ![]() v(NO2)=0.01mol/(Ls),故答案为:0.01。
v(NO2)=0.01mol/(Ls),故答案为:0.01。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案