题目内容
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
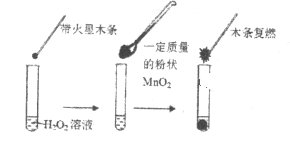
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1%H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积 | 49 | 61 | 86 |
由此得出的结论是______________。
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有![]() )
)
试管 | I | II | III |
滴加试剂 | 5滴 | 5滴 | 5滴 0.3 |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是___________,实验III的目的是___________。
(4)查阅资料得知:将作为催化剂的![]() 溶液加入
溶液加入![]() 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中![]() 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是_________________和_________________(按反应发生的顺序写)。
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是_________________和_________________(按反应发生的顺序写)。
【答案】不能 因为没有确认![]() 的质量和化学性质是否改变 在一定质量范围内,
的质量和化学性质是否改变 在一定质量范围内,![]() 质量越大,反应速率越快
质量越大,反应速率越快 ![]() 和
和![]() 对
对![]() 的分解均有催化作用,且
的分解均有催化作用,且![]() 比
比![]() 催化效果好 做对比实验,证明
催化效果好 做对比实验,证明![]() 对
对![]() 的分解没有催化作用
的分解没有催化作用 ![]()
![]()
【解析】
(1)该实验中没有确认![]() 的质量和化学性质是否改变,所以不能确定二氧化锰其催化剂作用;
的质量和化学性质是否改变,所以不能确定二氧化锰其催化剂作用;
(2).从表中数据分析,二氧化锰的质量越大,反应速率越快,所以说明在一定质量范围内,![]() 质量越大,反应速率越快;
质量越大,反应速率越快;
(3)实验中加入的铁离子和铜离子对实验有影响,且 ![]() 和
和![]() 对
对![]() 的分解均有催化作用,且
的分解均有催化作用,且![]() 比
比![]() 催化效果好;实验III的目的是做对比实验,证明
催化效果好;实验III的目的是做对比实验,证明![]() 对
对![]() 的分解没有催化作用;
的分解没有催化作用;
(4) 氯化铁中的铁离子具有氧化性,所以和过氧化氢反应中氯化铁做氧化剂,过氧化氢做还原剂,生成氧气和氯化亚铁,下一个反应中氯化亚铁做还原剂,过氧化氢做氧化剂生成水,反应的方程式为:2FeCl3+H2O2=2FeCl2+O2↑+2HCl、2FeCl2+H2O2+2HCl =2FeCl3+2H2O。

【题目】请应用化学反应原理的相关知识解决下列问题:
![]() 已知NaCl的溶解热为
已知NaCl的溶解热为![]() 吸热
吸热![]()
![]()
![]()
![]()
![]()
写出钠在氯气中燃烧的热化学方程式:__________。
![]() 一定条件下,在
一定条件下,在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 发生反应:
发生反应:![]() ,如图所示为反应体系中
,如图所示为反应体系中![]() 的平衡转化率与温度的关系曲线。已知在温度为
的平衡转化率与温度的关系曲线。已知在温度为![]() 的条件下,该反应
的条件下,该反应![]() 达到平衡状态;
达到平衡状态;
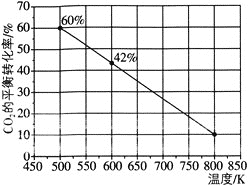
![]() 该反应是________
该反应是________![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
![]() 在
在![]() 时段反应速率
时段反应速率![]() 为_________。
为_________。
![]() 若改充入
若改充入![]() 和
和![]() ,图中的曲线会_________
,图中的曲线会_________![]() 填“
填“![]() 。
。
![]() 根据下表数据回答问题:
根据下表数据回答问题:
表1 ![]() 时浓度为
时浓度为![]() 两种溶液的pH
两种溶液的pH
溶质 | NaClO |
|
pH |
|
|
表2 ![]() 时两种酸的电离平衡常数
时两种酸的电离平衡常数
|
| |
|
|
|
|
|
|
![]() 根据表1能不能判断出
根据表1能不能判断出![]() 与HClO酸性强弱?_____________
与HClO酸性强弱?_____________![]() 填“能”或“不能”
填“能”或“不能”![]() 。
。
![]() 溶液中离子浓度由大到小的顺序为__________。
溶液中离子浓度由大到小的顺序为__________。
![]() 溶液和
溶液和![]() 溶液反应的离子方程式为________。
溶液反应的离子方程式为________。
![]() 已知:
已知:![]() 时,
时,![]() 、
、![]() ;AgCl为白色沉淀,
;AgCl为白色沉淀,![]() 为砖红色沉淀。
为砖红色沉淀。![]() 时,向
时,向![]() 和
和![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 溶液至过量且不断搅拌,实验现象为__________。
溶液至过量且不断搅拌,实验现象为__________。