题目内容
【题目】常温下,下列溶液中水的电离程度最大的是
A.pH=5的硫酸B.pH=10 的NaOH溶液
C.pH=5的氯化铵溶液D.pH=10的纯碱溶液
【答案】D
【解析】
A.pH=5的硫酸,抑制水的电离,溶液中的c(H+)=105mol/L,c(OH-)=![]() =10-9 mol/L,则由水电离的c水(H+)= c水(OH)=10-9 mol/L;
=10-9 mol/L,则由水电离的c水(H+)= c水(OH)=10-9 mol/L;
B.pH=10 的NaOH溶液抑制水的电离,溶液中的c(H+)=1010mol/L,则由水电离的c水(H+)= c水(OH)= 10-10 mol/L;
C.pH=5的氯化铵溶液中铵根离子水解促进水的电离,由水电离的氢离子浓度c水(H+)= c水(OH)=10-5 mol/L;
D.pH=10的纯碱溶液中碳酸根离子水解促进水的电离,氢氧根离子浓度c(OH)=104mol/L,则c水(H+)= c水(OH)= 10-4 mol/L;
故水的电离程度最大的是pH=10的纯碱溶液,D项正确;
答案选D。

练习册系列答案
相关题目
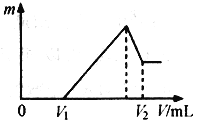
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 工业制硫酸中,在矿石处理阶段,将矿石粉碎再煅烧 | 增大反应物的接触面积,加快化学反应速率 |
B | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入MnO2,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
C | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
D | 一定条件下:H2(g)+I2(g) | c(I2)增大,I2物质的量增多 |
A. A B. B C. C D. D