题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.CO2通过Na2O2使其增重a g时,反应中转移的电子数为a/28NA
B.60gSi02中含Si—O键的个数为2NA
C.10g49%的硫酸与10g49%的H3PO4溶液中所含的氧原子数均为0.2NA
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
【答案】A
【解析】
A. 过氧化钠与二氧化碳反应中,电子的得失全部发生在过氧化钠中-1价的O,其中1个O失去一个电子转为1个O原子,而另一个O得到一个电子转为-2价,即生成1molO2需要2molNa2O2,转移的电子为2mol,根据方程式: 2CO2 + 2Na2O2 = 2Na2CO3 + O2 对应电子为2mol时, 固体增重=106×2-78×2=56g,则增重a g时,反应中转移的电子数为![]() ,即 a/28NA,故A正确;
,即 a/28NA,故A正确;
B. n(Si02)=![]() ,每个硅原子和4个氧原子形成4个Si—O键,所以60gSi02中含Si—O键的个数为4NA,故B错误;
,每个硅原子和4个氧原子形成4个Si—O键,所以60gSi02中含Si—O键的个数为4NA,故B错误;
C. 忽略了溶液中的水中含有的氧原子数,故C错误;
D. 不是标准状态下,则22.4L气体不一定为1mol,则22.4L的CO气体与lmol N2所含的电子数不一定相等,故D错误。
故选A。

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
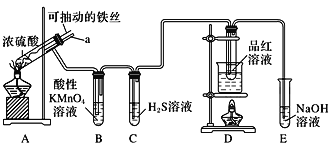
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 |
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+ |
C.装置D中品红溶液褪色可以验证SO2的漂白性 |
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 |
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:0.5 ℃,有毒)常温下是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成,并以液态储存。

(1)甲组的同学拟制备原料气NO和Cl2,均采用上图制备装置:
①写出NOCl的N元素化合价:_______
②为制备纯净干燥的气体,下表中缺少的药品是(填写在横线上):
实验项目 | 装置Ⅰ | 装置Ⅱ | |
制备的气体 | 烧瓶中 | 分液漏斗中 | |
a .制备纯净干燥的Cl2 | MnO2 | _______ | _______ |
b .制备纯净干燥的NO | Cu | _______ | _______ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
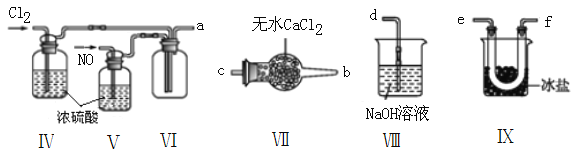
①装置连接顺序为a→____________________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是______________________________。
③装置Ⅵ在实验结束,拆解装置前,应作怎样的处理?_________________________。
④装置Ⅷ中吸收尾气时,NOCl发生的非氧化还原反应的化学方程式为___________________。
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
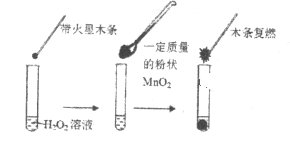
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1%H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积 | 49 | 61 | 86 |
由此得出的结论是______________。
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有![]() )
)
试管 | I | II | III |
滴加试剂 | 5滴 | 5滴 | 5滴 0.3 |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是___________,实验III的目的是___________。
(4)查阅资料得知:将作为催化剂的![]() 溶液加入
溶液加入![]() 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中![]() 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是_________________和_________________(按反应发生的顺序写)。
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是_________________和_________________(按反应发生的顺序写)。