题目内容
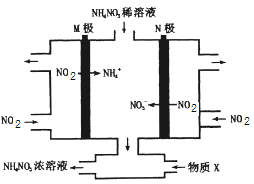
【题目】下列有关装置图的叙述正确的是
A. 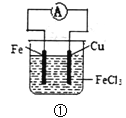 装置①中的总反应为:Cu+2Fe3+=Cu2++2Fe2+
装置①中的总反应为:Cu+2Fe3+=Cu2++2Fe2+
B. 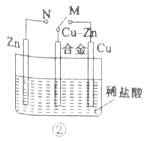 装置②中的开关由M改置于N时,Cu-Zn合金的腐蚀速度增大
装置②中的开关由M改置于N时,Cu-Zn合金的腐蚀速度增大
C.  装置③中在Fe电极区无蓝色沉淀,该方法叫牺牲阳极的阴极保护法
装置③中在Fe电极区无蓝色沉淀,该方法叫牺牲阳极的阴极保护法
D. 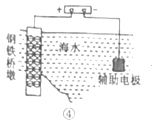 装置④中桥墩与外加电源正极连接能确保桥墩不被腐蚀
装置④中桥墩与外加电源正极连接能确保桥墩不被腐蚀
【答案】C
【解析】
A、①装置是原电池,铁活泼性大于铜,金属Fe作负极失去电子,总反应为Fe+2Fe3+=3Fe2+,故A错误;
B、装置②中的开关由M改置于N时,纯锌是负极,合金的腐蚀速率减慢,故B错误;
C、装置③锌作负极,铁作正极,发生的是锌的吸氧腐蚀,是验证牺牲阳极的阴极保护法的实验装置,故C正确;
D、装置④中桥墩与外加电源负极连接能确保桥墩不被腐蚀,故D错误。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
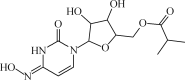
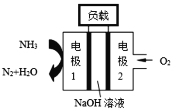
综合自测系列答案【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
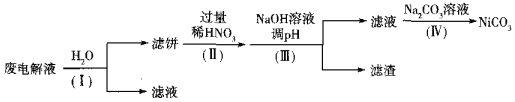
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
【题目】下列实验现象或图象信息不能充分说明相应的化学反应是放热反应的是( )
A | B | C | D | |
反应装置或图象 |
|
|
|
|
实验现象或图象信息 | 温度计的水银柱上升 | 反应物总能量大于生成物总能量 | 反应开始后,针筒活塞向右移动 | 反应开始后,甲处液面低于乙处液面 |
A.AB.BC.CD.D