题目内容
【题目】(1)已知在2L的固定容积的密闭容器中进行下列可逆反应,各物质的有关数据如下:
3A (g) + B (g)![]() 2C(g)
2C(g)
起始物质的量浓度(mol/L):1.5 1 0
2s末物质的量浓度(mol/L):0.9 0.8 0.4
则:①0到2s用物质C来表示的反应速率为_________________;
②从反应开始到2s末,B的转化率为________________;
③下列事实不能够说明上述反应在该条件下已经达到化学平衡状态的是_______。
A.气体的平均相对分子质量保持不变
B.容器内气体的密度不变
C.容器内气体的总压强保持不变
D.vA︰vB︰vC=3︰2︰2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO。则该电池的负极材料是_________;当导线中有0.4 mol电子通过时,理论上消耗的O2在标准状况下的体积是_______ L。
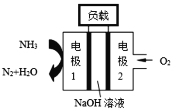
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如右,该燃料电池工作时,外电路中电流方向是从电极_____到电极_____;电池的总反应为______________________。
【答案】0.2 mol/(L·s) 20% BD 锌 2.24 2 1 4NH3+3O2=2N2+6H2O
【解析】
(1)①v(C)=![]() = 0.2 mol/(L·s),故答案为:0.2 mol/(L·s);
= 0.2 mol/(L·s),故答案为:0.2 mol/(L·s);
②反应开始到2s,![]() c(B)=1mol/L-0.8mol/L=0.2mol/L,所以,B的转化率=
c(B)=1mol/L-0.8mol/L=0.2mol/L,所以,B的转化率=![]() =20%,故答案为:20%;
=20%,故答案为:20%;
③3A (g) + B (g)![]() 2C(g):
2C(g):
A.气体总质量m不变,气体的平均相对分子质量保持不变,则M不变,由n=![]() 可知,气体的总物质的量n不变,说明已平衡,A错误;
可知,气体的总物质的量n不变,说明已平衡,A错误;
B.容器体积V不变,气体总质量m不变,由![]() 可知,无论是否平衡密度均不变,即密度不变,不能说明反应是否平衡,B正确;
可知,无论是否平衡密度均不变,即密度不变,不能说明反应是否平衡,B正确;
C.正反应是气体分子数减小的反应,当容器内气体的总压强保持不变,说明反应已平衡,C错误;
D.反应速率之比=化学计量数之比,即无论是否达到平衡,都有vA︰vB︰vC=3︰2︰2,那么,当vA︰vB︰vC=3︰2︰2时,无法说明反应是否已达平衡,D正确;
E.容器内气体C的物质的量分数保持不变,说明反应已达平衡,E错误;
综上所述,BD符合题意,故答案为:BD;
(2)①Zn元素化合价升高,失电子,则锌为该电池的负极材料。由2Zn+O2=2ZnO可知,每1molO2参与反应时,转移4mol电子,当导线中有0.4 mol电子通过时,消耗O2的物质的量=0.1mol,对应的体积=0.1mol×22.4L/mol=2.24L,故答案为:锌;2.24L;
②结合图可知,NH3失电子,发生氧化反应得到N2和H2O,说明电极1为负极,则电极2位正极,所以,电流方向为:电极2→负载→电极1。该电池的反应物为NH3和O2,生成物为N2和H2O,则该电池的总反应为:4NH3+3O2=2N2+6H2O,故答案为:2;1;4NH3+3O2=2N2+6H2O。