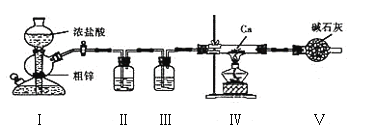
题目内容
【题目】工业上可以通过电解NO2制备NH4NO3,其工作原理如图所示,下列说法正确的是
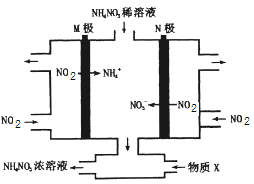
A. 电解过程中,阴极区NO2流入速率比阳极区NO2流入速率快些
B. 阴极区消耗1molNO2需补充6mol化合物X
C. 阳极反应为:NO2+e-+H2O=NO3-+2H+
D. 电解过程中,阴极区的pH小于阳极区的pH
【答案】B
【解析】
阳极二氧化氮失电子生成硝酸根离子,电极反应式是NO2-e-+H2O= NO3-+2H+;阴极二氧化氮得电子生成铵根离子,电极反应式是NO2+7e-+8H+=NH4++2H2O;
A、阳极反应式是NO2-e-+H2O= NO3-+2H+;阴极反应式是NO2+7e-+8H+=NH4++2H2O,根据转移电子数相同,阳极区NO2流入速率比阴极区NO2流入速率快些,故A错误;
B、根据电子守恒,阴极区消耗1molNO2生成1mol NH4+,阳极同时生成7mol NO3-,要制备NH4NO3,需要补充6mol氨气,故B正确;
C、 阳极反应为:NO2-e-+H2O= NO3-+2H+,故C错误;
D. 电解过程中,阴极区发生NO2+7e-+8H+=NH4++2H2O,消耗氢离子pH增大,阳极反应式是NO2-e-+H2O= NO3-+2H+,生成氢离子pH降低,阴极区的pH大于阳极区的pH,故D错误。

练习册系列答案
相关题目