题目内容
【题目】碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)△H1
反应Ⅱ:HI(aq)═![]() H2(g)+
H2(g)+![]() I2(aq)△H2
I2(aq)△H2
反应Ⅲ:2H2SO4(aq)═2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)═H2SO4(aq)+H2(g)的△H═______(用△H1、△H2表示);
②分析上述反应,下列判断正确的是______;
A.反应Ⅲ易在常温下进行
B.反应I中SO2还原性比HI强
C.循环过程中需补充H2O
D.循环过程中产生1molO2同时产生1molH2
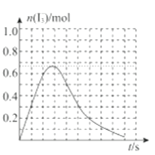
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2.缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是:______;
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量还能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:______;
(3)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)═______[用c(Cl-)、Ksp(AgCl)和Ksp(AgI)表示].该方法去除碘离子的原理是______。
【答案】△H1+2△H2 BC 开始阶段,SO2和I2反应生成的I-的浓度不断增大,I2(aq)+I-(aq) ![]() I3-(aq)的反应平衡向右移动,n(I3-)不断增加 5Cl2+I2+6H2O=2IO3-+10Cl-+12H+
I3-(aq)的反应平衡向右移动,n(I3-)不断增加 5Cl2+I2+6H2O=2IO3-+10Cl-+12H+  AgI的溶度积比AgCl的溶度积小
AgI的溶度积比AgCl的溶度积小
【解析】
(1)利用已知热化学反应求解未知热化学反应时,可利用盖斯定律进行计算,计算时,可根据未知反应,确定已知反应是否需要调整反应物与生成物,是否需要调整化学计量数。
(2)在分析图象信息时,从发生的反应入手,根据生成物的浓度变化,确定平衡移动的方向,寻找浓度变化的原因。
(3)在分析沉淀溶解平衡时,虽然涉及两个平衡体系,仍可像对待一般的化学平衡一样进行处理。
(1) ①a.SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq) △H1
b.HI(aq)═![]() H2(g)+
H2(g)+![]() I2(aq) △H2
I2(aq) △H2
由盖斯定律可知a+2×b得SO2(g)+2H2O(1)═H2SO4(aq)+H2(g) △H=△H1+2△H2。答案为:△H1+2△H2;
②A.△H-T△S<0的反应可自发进行,为吸热、熵增的反应,常温不能自发进行,A错误; B.I中还原剂的还原性大于还原产物的还原性,则SO2还原性比HI强,B正确;
C.将三个反应式相加,得出2H2O(1)==2H2(g)+O2(g),反应消耗水,需要不断补充,C正确; D.分解水生成氢气和氧气的体积比为2:1,则产生1molO2同时产生2molH2,D错误。答案为:BC;
③n(I3-)逐渐增大的原因是开始阶段,SO2和I2反应生成的I-的浓度不断增大,I2(aq)+I-(aq) ![]() I3-(aq)的反应平衡向右移动,n(I3-)不断增加。答案为:开始阶段,SO2和I2反应生成I-的浓度不断增大,I2(aq)+I-(aq)
I3-(aq)的反应平衡向右移动,n(I3-)不断增加。答案为:开始阶段,SO2和I2反应生成I-的浓度不断增大,I2(aq)+I-(aq) ![]() I3-(aq)的反应平衡向右移动,n(I3-)不断增加;
I3-(aq)的反应平衡向右移动,n(I3-)不断增加;
(2)酸性条件下,若氯气过量还能将碘单质进一步氧化成碘酸根离子(IO3-),氯气与碘单质反应的离子方程式为5Cl2+I2+6H2O=2IO3-+10Cl-+12H+。答案为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+;
(3)吸附反应为I-(aq) +AgCl(s)AgI(s)+Cl-(aq),反应达到平衡后,c(I-)=![]() =
= ,去除碘离子的原理是AgI溶度积比AgCl的溶度积小,发生沉淀的转化。答案为:
,去除碘离子的原理是AgI溶度积比AgCl的溶度积小,发生沉淀的转化。答案为: ;AgI溶度积比AgCl的溶度积小。
;AgI溶度积比AgCl的溶度积小。

【题目】二氧化锰无论在实验室还是在生产、生活中均有广泛应用。工业上可以用制备对苯二酚的废液为原料生产二氧化锰。此工艺对节约资源、保护环境、提高经济效益有着重要意义。
(1)经分析知该废液中含有硫酸锰、硫酸铵、硫酸以及Fe2+、Co2+、Ni2+等金属离子。以此为原料制备化学二氧化锰的流程如图所示。
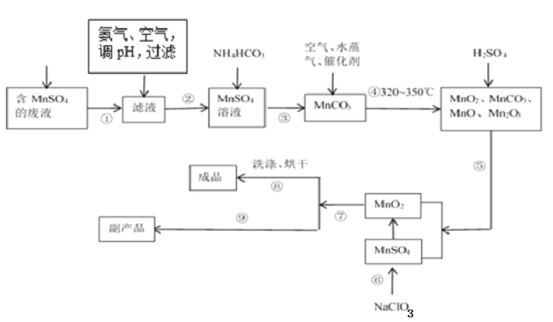
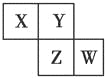
①常温下几种有关难溶硫化物的溶度积常数如下表,若除去Fe2+后的废液中Mn2+浓度为1mol/L,欲使Co2+和Ni2+完全沉淀,而Mn2+不受损失,S2-的浓度范围应控制在___mol/L。
化合物 | MnS | CoS(α型) | NiS |
Ksp | 2.5×10-10 | 4×10-21 | 1.07×10-21 |
②步骤⑥的化学方程式为___。
③步骤①~⑨中涉及到过滤的操作有___。(填序号)
④步骤⑨得到的副产品的化学式为___,其重要的用途之一是___。得到该副产品的操作是___。
(2)生产电解二氧化锰的原理是在93℃左右以石墨为电极电解硫酸锰和硫酸的混合溶液,写出阳极的电极反应式___,若电解过程中的电压为3V,理论上生产1tMnO2消耗电能___kw·h。(1kw·h=3.6×106J)
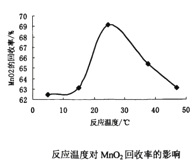
(3)双氧水氧化法制备二氧化锰时所发生的反应为MnSO4+2NH3+H2O2→MnO2+(NH4)2SO4,在溶液的pH、过氧化氢的用量和反应时间一定的情况下,温度对实验结果的影响如图所示。MnO2的回收率随着温度升高先增大后减小的可能原因是___。
【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图: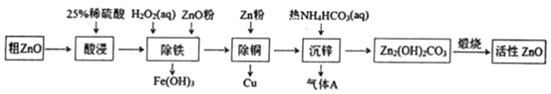
已知相关氢氧化物沉淀pH范围如表所示
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O
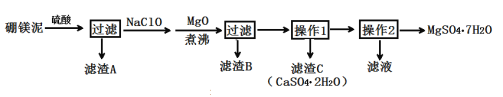
【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。