题目内容
【题目】研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I. 已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1 ②CO的燃烧热△H= - 283 kJ·mol-1
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为_________________________________________________。
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行该反应,下列能判断反应达到化学平衡状态的是_______。
①单位时间内消耗a mo1 CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
t/s | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器(T1)n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器(T2)n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
(3)T1___T2(填>、<或=,下同),该反应ΔH___0 。简述理由________________________________。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=______________________。
(5)甲容器中NO2平衡转化率为________,T1时该反应的平衡常数为_______________________。
III. 将NO2(g)转化为N2O4(g),再以
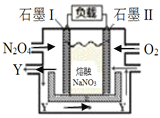
(6)石墨I为______极(选填正、负),Y化学式为_________。
(7)II电极反应式为_________________________________________。
【答案】 2NO(g)+2CO(g)![]() N2(g) +2CO2(g) △H=-746.5kJ/mol ②③ > < T1温度下反应速率更快,所以温度更高,T1>T2;T2条件下平衡时,生成n(O2)更多,说明降温平衡正向移动,所以ΔH<0 0.24mol·L-1·s-1 80% 20 L/mol 负 N2O5 O2 +4e- +2N2O5 =4NO3-
N2(g) +2CO2(g) △H=-746.5kJ/mol ②③ > < T1温度下反应速率更快,所以温度更高,T1>T2;T2条件下平衡时,生成n(O2)更多,说明降温平衡正向移动,所以ΔH<0 0.24mol·L-1·s-1 80% 20 L/mol 负 N2O5 O2 +4e- +2N2O5 =4NO3-
【解析】I. (1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质生成物为氮气和二氧化碳,反应的化学方程式为2NO+2CO![]() N2+2CO2;根据①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1,②CO的燃烧热△H= - 283 kJ·mol-1,热化学方程式为CO(g)+
N2+2CO2;根据①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1,②CO的燃烧热△H= - 283 kJ·mol-1,热化学方程式为CO(g)+ ![]() O2(g)= CO2(g) △H= - 283 kJ·mol-1,根据盖斯定律,将②×2-①得2NO(g)+2CO(g)
O2(g)= CO2(g) △H= - 283 kJ·mol-1,根据盖斯定律,将②×2-①得2NO(g)+2CO(g)![]() N2(g) +2CO2(g) △H=(- 283 kJ·mol-1)×2-(+180.5kJ·mol-1)=-746.5kJ/mol,故答案为:2NO(g)+2CO(g)
N2(g) +2CO2(g) △H=(- 283 kJ·mol-1)×2-(+180.5kJ·mol-1)=-746.5kJ/mol,故答案为:2NO(g)+2CO(g)![]() N2(g) +2CO2(g) △H=-746.5kJ/mol;
N2(g) +2CO2(g) △H=-746.5kJ/mol;
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行2NO+2CO![]() N2+2CO2。①单位时间内消耗a mo1 CO的同时生成2a mol NO,表示逆反应速率大于正反应速率,不是平衡状态,故错误;②该反应前后气体的质量不变,物质的量减少,混合气体的平均相对分子质量不再改变,表示气体的物质的量不变,能够说明达到了平衡状态,故正确;③混合气体中NO和CO的起始物质的量之比与反应的物质的量之比不同,因此随着反应的进行,物质的量之比发生变化,当物质的量之比保持不变,能够说明达到了平衡状态,故正确;④混合气体的体积和质量始终不变,说明始终密度不变,不能说明是平衡状态,故错误;故选②③;
N2+2CO2。①单位时间内消耗a mo1 CO的同时生成2a mol NO,表示逆反应速率大于正反应速率,不是平衡状态,故错误;②该反应前后气体的质量不变,物质的量减少,混合气体的平均相对分子质量不再改变,表示气体的物质的量不变,能够说明达到了平衡状态,故正确;③混合气体中NO和CO的起始物质的量之比与反应的物质的量之比不同,因此随着反应的进行,物质的量之比发生变化,当物质的量之比保持不变,能够说明达到了平衡状态,故正确;④混合气体的体积和质量始终不变,说明始终密度不变,不能说明是平衡状态,故错误;故选②③;
II. (3)向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,发生反应2NO2(g)+O3(g)![]() N2O5(g)+O2(g),根据表格数据,T1温度下建立平衡需要的时间短,说明T1>T2,平衡时,T1温度下n(O2)大于T2温度下n(O2),说明降低温度,平衡正向移动,正反应为放热反应,ΔH<0,故答案为:>;<;T1温度下反应速率更快,所以温度更高,T1>T2;T2条件下平衡时,生成n(O2)更多,说明降温平衡正向移动,所以ΔH<0;
N2O5(g)+O2(g),根据表格数据,T1温度下建立平衡需要的时间短,说明T1>T2,平衡时,T1温度下n(O2)大于T2温度下n(O2),说明降低温度,平衡正向移动,正反应为放热反应,ΔH<0,故答案为:>;<;T1温度下反应速率更快,所以温度更高,T1>T2;T2条件下平衡时,生成n(O2)更多,说明降温平衡正向移动,所以ΔH<0;
(4)甲容器中,0~3s内的平均反应速率v(O2)=  =0.12 mol·L-1·s-1,则v(NO2)=2 v(O2)= 0.24 mol·L-1·s-1,故答案为:0.24 mol·L-1·s-1;
=0.12 mol·L-1·s-1,则v(NO2)=2 v(O2)= 0.24 mol·L-1·s-1,故答案为:0.24 mol·L-1·s-1;
(5)平衡时,甲容器中O2为0.80mol,则反应的NO2为1.60mol,NO2平衡转化率为![]() ×100%=80%;T1时该反应的平衡常数K=
×100%=80%;T1时该反应的平衡常数K=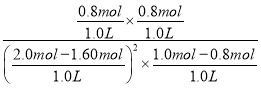 = 20 L/mol,故答案为:80%;20 L/mol;
= 20 L/mol,故答案为:80%;20 L/mol;
III.(6)通入氧气的电极为正极,即石墨II电极为正极,则石墨I为负极;以N2O4、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,N2O4在负极失电子发生氧化反应,元素化合价升高为+5价,氧化物为N2O5,故答案为:负;N2O5;
(7)根据图示,N2O4在负极(石墨I)失电子发生氧化反应生成Y,电极反应式为N2O4+2NO3--2e-=2N2O5,Y和氧气在石墨II电极上发生还原反应生成NO3-,电极反应式为O2 +4e- +2N2O5 =4NO3-,故答案为:O2 +4e- +2N2O5 =4NO3-。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案