题目内容
【题目】接触法制硫酸工艺中,主反应在450℃并有催化剂存在下进行:![]()
![]()
(1)恒温恒容条件下,下列能说明此反应已达平衡的是________。
①![]()
②容器中气体的平均摩尔质量不随时间而变化
③容器中气体的密度不随时间而变化
④容器中气体分子总数不随时间而变化
(2)下列有关该反应速率的叙述中,正确的是_________。
a. 升高温度可以增大活化分子百分数,加快反应速率
b. 使用催化剂提高二氧化硫的转化率
c. 使用催化剂可以使反应物分子平均能量升高,加快反应速率
d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率
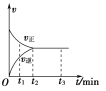
(3)下图表示将![]() 和
和![]() 置于2L密闭容器中,当其他条件一定时,
置于2L密闭容器中,当其他条件一定时, ![]() 的平衡转化率a随X的变化关系,
的平衡转化率a随X的变化关系, ![]() 代表压强或温度。X代表的物理量是___________。A对应条件下平衡常数K=___________。
代表压强或温度。X代表的物理量是___________。A对应条件下平衡常数K=___________。

(4)一定温度下,在容积不变的密闭容器中充入![]() 和
和![]() ,达平衡时
,达平衡时![]() 的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后
的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后![]() 的体积分数仍为a%的是__________。
的体积分数仍为a%的是__________。
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
(5)![]() 与
与![]() 反应生成
反应生成![]() ,
, ![]() 电离方程式为___________,向
电离方程式为___________,向![]() 溶液中加入
溶液中加入![]() 固体,则电离平衡往__________反应方向移动。
固体,则电离平衡往__________反应方向移动。
【答案】 .②④ ad 压强 160 cd H2SO3![]() H++HSO3-,HSO3-
H++HSO3-,HSO3-![]() H++SO32- 正
H++SO32- 正
【解析】(1)①因化学方程式的系数之比等于化学反应中各物质的反应速率之比,v(O2)正=![]() v(SO3)正,又因v(O2)正=2v(SO3)逆,所以v(SO3)正和v(SO3)逆不相等,不是否达到平衡,故①错误;②气体的平均摩尔质量等于
v(SO3)正,又因v(O2)正=2v(SO3)逆,所以v(SO3)正和v(SO3)逆不相等,不是否达到平衡,故①错误;②气体的平均摩尔质量等于![]() ,根据质量守恒定律,反应过程中气体的总质量不变,该反应为气体的分子总数减少的反应,若混合气体的平均摩尔质量不变,说明平衡混合物中各组成成分含量不变,反应达到平衡状态,故②正确;③气体的密度ρ=
,根据质量守恒定律,反应过程中气体的总质量不变,该反应为气体的分子总数减少的反应,若混合气体的平均摩尔质量不变,说明平衡混合物中各组成成分含量不变,反应达到平衡状态,故②正确;③气体的密度ρ=![]() ,根据质量守恒定律,反应过程中气体的总质量不变,容器体积不变,气体的密度不会发生变化,故容器中气体的密度不随时间而变化,不能判断反应是否达到平衡,故③错误;④该反应为气体的分子总数减少的反应,当容器中气体的分子总数不随时间而变化时,平衡混合物中各组成成分含量不变,反应达到平衡状态,故④正确;故选:②④;
,根据质量守恒定律,反应过程中气体的总质量不变,容器体积不变,气体的密度不会发生变化,故容器中气体的密度不随时间而变化,不能判断反应是否达到平衡,故③错误;④该反应为气体的分子总数减少的反应,当容器中气体的分子总数不随时间而变化时,平衡混合物中各组成成分含量不变,反应达到平衡状态,故④正确;故选:②④;
(2)a.升高温度可以增大活化分子百分数,有效碰撞的次数增加,则加快反应速率,故a正确;b. 使用催化剂,平衡不移动,二氧化硫的转化率不变,故b错误;c.使用催化剂,降低反应的活化能,加快反应速率,但反应物分子平均能量不变,故c错误;d.缩小容器体积,压强增大,参加反应气体的浓度增大,反应速率加快,故d正确,故答案为:ad;
(3)2SO2(g)+O2(g) ![]() 2SO3(g)△H<0,正反应是放热反应,所以升高温度,平衡逆向移动,SO2(g)的平衡转化率α减小,而增大压强平衡正向移动,SO2(g)的平衡转化率α增大,所以X代表的物理量是压强;反应达平衡后,由图可知,SO2的平衡转化率α=0.80,参加反应的二氧化硫为2mol×80%=1.6mol,则:
2SO3(g)△H<0,正反应是放热反应,所以升高温度,平衡逆向移动,SO2(g)的平衡转化率α减小,而增大压强平衡正向移动,SO2(g)的平衡转化率α增大,所以X代表的物理量是压强;反应达平衡后,由图可知,SO2的平衡转化率α=0.80,参加反应的二氧化硫为2mol×80%=1.6mol,则:
2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
开始(mol):2 1 0
变化(mol):1.6 0.8 1.6
平衡(mol):0.4 0.2 1.6
所以平衡时浓度:c(SO2)=0.2 mol/L,c(O2)=0.1mol/L,c(SO3)=0.8mol/L,故平衡常数K=![]() =160,故答案为:压强;160;
=160,故答案为:压强;160;
(4)一定温度下,在容积不变的密闭容器中充入![]() 和
和![]() ,达平衡时
,达平衡时![]() 的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后
的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后![]() 的体积分数仍为a%需要转化为SO2、O2物质的量分别相等。a.若将2 mol SO3全部转化为SO2、O2,得到2 mol SO2和1 mol O2,与原平衡状态不同,故a错误;b2mol SO2、1mol O2,与原平衡状态不同,故b错误;c. 若将4mol SO3全部转化为SO2、O2,得到4mol SO2和2 mol O2,与原平衡状态相同,故c正确;d.
的体积分数仍为a%需要转化为SO2、O2物质的量分别相等。a.若将2 mol SO3全部转化为SO2、O2,得到2 mol SO2和1 mol O2,与原平衡状态不同,故a错误;b2mol SO2、1mol O2,与原平衡状态不同,故b错误;c. 若将4mol SO3全部转化为SO2、O2,得到4mol SO2和2 mol O2,与原平衡状态相同,故c正确;d. ![]() ,相当于4mol SO2和2mol O2,与原平衡状态相同,故d正确;故答案为:cd;
,相当于4mol SO2和2mol O2,与原平衡状态相同,故d正确;故答案为:cd;
(5) ![]() 与
与![]() 反应生成
反应生成![]() ,
, ![]() 属于中强酸,部分电离,电离方程式为H2SO3
属于中强酸,部分电离,电离方程式为H2SO3![]() H++HSO3-,HSO3-
H++HSO3-,HSO3-![]() H++SO32-;向
H++SO32-;向![]() 溶液中加入
溶液中加入![]() 固体,碳酸氢钠与电离出的氢离子反应删除二氧化碳,c(H+)减小,促进亚硫酸的电离,电离平衡往正反应方向移动,故答案为:H2SO3
固体,碳酸氢钠与电离出的氢离子反应删除二氧化碳,c(H+)减小,促进亚硫酸的电离,电离平衡往正反应方向移动,故答案为:H2SO3![]() H++HSO3-,HSO3-
H++HSO3-,HSO3-![]() H++SO32-;正。
H++SO32-;正。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案