题目内容
3.X、Y为同周期元素,如果X的原子半径大于Y,则下列说法不正确的是( )| A. | 若X、Y均为金属元素,则X的金属性强于Y | |
| B. | 若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子氧化性强 | |
| C. | 若X、Y均为非金属元素,则Y的气态氢化物比X的稳定 | |
| D. | 若X、Y均为非金属元素,则最高价氧化物所对应的水化物的酸性Y强于X |
分析 X、Y为同周期元素,如果X的原子半径大于Y,则Y的原子序数大,同周期,原子序数大的金属性弱、非金属性强,以此来解答.
解答 解:X、Y为同周期元素,如果X的原子半径大于Y,则Y的原子序数大,
A.若X、Y均为金属元素,同周期原子序数大的金属性弱,则X的金属性强于Y,故A正确;
B.若X、Y均为金属元素,金属性强的对应阳离子的氧化性弱,则X的阳离子氧化性比Y形成的阳离子弱,故B错误;
C.若X、Y均为非金属元素,同周期,原子序数大的非金属性强,则Y的气态氢化物比X的稳定,故C正确;
D.若X、Y均为非金属元素,同周期,原子序数大的非金属性强,则最高价含氧酸的酸性Y强于X,故D正确;
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握同周期原子半径的关系及元素周期律等为解答的关键,注意金属性、非金属性的比较方法,题目难度不大.

练习册系列答案
相关题目
13.0.1mol某烃完全燃烧时生成30.8gCO2和12.6gH2O,且能使酸性高锰酸钾溶液褪色,若其结构中只含有两个-CH3,则该物质的结构(不考虑顺反异构)最多有( )
| A. | 6种 | B. | 8种 | C. | 7种 | D. | 10种 |
14.对于放热反应2H2+O2$\frac{\underline{\;高温\;}}{\;}$2H2O,下列说法中正确的是( )
| A. | 产物H2O所具有的总能量高于反应物H2和O2所具有的总能量 | |
| B. | 反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 | |
| C. | 反应物H2和O2所具有的总能量等于产物H2O所具有的总能量 | |
| D. | 反应物H2和O2所具有的总能量与产物H2O所具有的总能量之间没有直接关系 |
11.下列各组有机物中,其一氯代物的数目不相等的是( )
(1)正戊烷和正己烷
(2)苯和乙烷
(3)对二甲苯和2,2-二甲基丙烷
(4)甲苯和2-甲基丙烷.
(1)正戊烷和正己烷
(2)苯和乙烷
(3)对二甲苯和2,2-二甲基丙烷
(4)甲苯和2-甲基丙烷.
| A. | (2)(4) | B. | (3)(4) | C. | (1)(3) | D. | (1)(2) |
18.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量,据此,试判断在100kPa压强下,下列结论正确的是( )
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol石墨与1mol金刚石完全燃烧放出的能量同样多 |
15.下列化学用语中,正确的是( )
| A. | 一氯乙烷的结构式CH3Cl | |
| B. | 丁烷的结构简式CH3(CH2)2CH3 | |
| C. | 氯化氢分子的形成过程可用电子式表示为: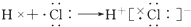 | |
| D. | 四氯化碳的电子式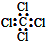 |
12.下列叙述正确的是( )
| A. | 氯水久置后pH增大 | |
| B. | Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg | |
| C. | 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | 可用澄清石灰水除去CO2中混有的少量SO2 |
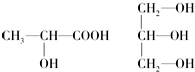
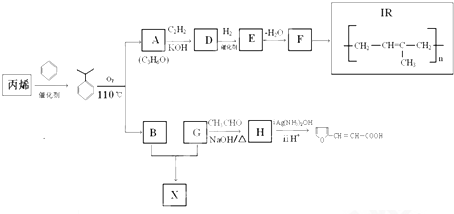
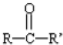 $\stackrel{KOH}{→}$H-C≡
$\stackrel{KOH}{→}$H-C≡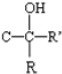
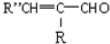 +H2O(-R、-R′、-R″表示肯呢个形态或可能不同的原子或原子团)
+H2O(-R、-R′、-R″表示肯呢个形态或可能不同的原子或原子团) ,反应类型是加成反应.
,反应类型是加成反应.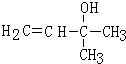 .
.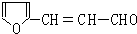 .
.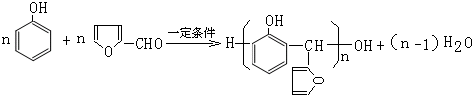 .
.