题目内容
15.下列化学用语中,正确的是( )| A. | 一氯乙烷的结构式CH3Cl | |
| B. | 丁烷的结构简式CH3(CH2)2CH3 | |
| C. | 氯化氢分子的形成过程可用电子式表示为: | |
| D. | 四氯化碳的电子式 |
分析 A.CH3Cl为一氯甲烷的结构简式,不是结构式;
B.丁烷为含有4个C原子、无支链的饱和烃;
C.氯化氢为共价化合物,氯化氢中不存在阴阳离子,电子式中不能标出电荷;
D.漏掉了氯原子的最外层的3对未成键电子对.
解答 解:A.结构式中应该用短线代替所有的共用电子对,一氯甲烷的结构式为: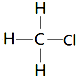 ,故A错误;
,故A错误;
B.丁烷的结构简式为CH3(CH2)2CH3,故B正确;
C.氯化氢属于共价化合物,分子中不存在阴阳离子,用电子式表示氯化氢的形成过程为: ,故C错误;
,故C错误;
D.四氯化碳为共价化合物,分子中存在4个碳氯共用电子对,碳原子和氯原子最外层都达到8电子稳定结构,四氯化碳正确的电子式为: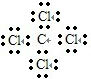 ,故D错误;
,故D错误;
故选B.
点评 本题考查了电子式、结构简式、结构式等知识,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,试题培养了学生的分析能力及规范答题能力.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
3.X、Y为同周期元素,如果X的原子半径大于Y,则下列说法不正确的是( )
| A. | 若X、Y均为金属元素,则X的金属性强于Y | |
| B. | 若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子氧化性强 | |
| C. | 若X、Y均为非金属元素,则Y的气态氢化物比X的稳定 | |
| D. | 若X、Y均为非金属元素,则最高价氧化物所对应的水化物的酸性Y强于X |
10.下列各组混合物不论它们的组分以何种比例混合,只要总质量一定,经过完全燃烧后,产生的CO2为一定量的是( )
| A. | 乙烷和乙烯 | B. | 丙烯和丙烷 | ||
| C. | 甲烷和己烷 | D. | 乙炔和乙烯基乙炔( CH2=CH-C≡CH) |
20.下列关于粒子结构的描述不正确的是( )
| A. | H2S和NH3价电子总数均是8 | |
| B. | 次氯酸分子的结构式为:H-Cl-O | |
| C. | HS-和HCl均是含一个极性键的18电子粒子 | |
| D. | 1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值) |
7.已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
| A. | 元素非金属性按X、Y、Z的顺序增强 | |
| B. | 简单阴离子的还原性按X、Y、Z的顺序减弱 | |
| C. | 气态氢化物的稳定性按X、Y、Z的顺序增强 | |
| D. | 单质的氧化性按X、Y、Z的顺序减弱 |
3.乙酰水杨酸即阿斯匹林(aspirin)是一种解热止痛、治疗感冒药,实验室制取原理为:

实验方学科王法:在干燥的锥形瓶中放入称量好的水杨酸(6.2g 0.045mol)、乙酸酐(5mL 5.4g0.053mol),滴入3mL浓硫酸,在70℃反应一段时间后,按如下流程分离出乙酰水杨酸.

已知:①乙酰水杨酸学科王溶于热水,在冷水中微溶;熔点:136°C,沸点:321.4°C.
②乙酰水杨酸钡、水杨酸钡均可溶于水.
③乙酸酐遇水生成乙酸.
④乙酰水杨酸钠易溶于水,上述学科王粗产物中有少量难溶于水的聚合物.
(1)反应后用40mL冰水稀释反应混合物的操作是:待反应液稍冷后,在玻璃棒不断搅拌下将反应液沿烧杯壁慢慢倒入40ml冰水中.
(2)操作Ⅰ为过滤.
(3)判断粗产物与饱和碳酸氢钠已反应完全的现象是:无气泡产生.
(4)某同学推测产品中可能还含有少量水杨酸和Na2SO4,设计了如下方案进行检验,实验证明不含杂质,请在答题卡上完成表中内容.
(5)产率计算:称量干燥后纯净产品质量为3.2g,该实验中乙酰水杨酸的产率为40%(保留三位有效数字).

实验方学科王法:在干燥的锥形瓶中放入称量好的水杨酸(6.2g 0.045mol)、乙酸酐(5mL 5.4g0.053mol),滴入3mL浓硫酸,在70℃反应一段时间后,按如下流程分离出乙酰水杨酸.

已知:①乙酰水杨酸学科王溶于热水,在冷水中微溶;熔点:136°C,沸点:321.4°C.
②乙酰水杨酸钡、水杨酸钡均可溶于水.
③乙酸酐遇水生成乙酸.
④乙酰水杨酸钠易溶于水,上述学科王粗产物中有少量难溶于水的聚合物.
(1)反应后用40mL冰水稀释反应混合物的操作是:待反应液稍冷后,在玻璃棒不断搅拌下将反应液沿烧杯壁慢慢倒入40ml冰水中.
(2)操作Ⅰ为过滤.
(3)判断粗产物与饱和碳酸氢钠已反应完全的现象是:无气泡产生.
(4)某同学推测产品中可能还含有少量水杨酸和Na2SO4,设计了如下方案进行检验,实验证明不含杂质,请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将少量产品加入6mL水的试管A中,振荡,将上层液体倾析至B、C中. | 得到白色晶体和无色溶液 | |
| ② | 向试管B中加入少量BaCl2溶液. (或取试管B中溶液做焰色反应实验). | 不产生白色沉淀(或焰色不呈黄色) | 产品中不含 Na2SO4 |
| ③ | 向试管C中,加入少量FeCl3溶液(或浓溴水). | 溶液不显紫色(或无白色沉淀出现). | 产品中不含水杨酸 |
 用没食子酸制造墨水主要利用了( )类化合物的性质.
用没食子酸制造墨水主要利用了( )类化合物的性质.
 ;
; ;
; 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题: