题目内容
【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
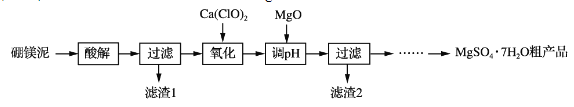
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
【答案】加热/搅拌/提高酸液浓度等避免调pH时消耗过多的MgOH2O2+2Fe2++2H+===2Fe3++2H2OH2O2不稳定易分解或Fe3+等金属离子会催化H2O2的分解防止加入的NaOH引入Na+杂质加热浓缩,趁热过滤;将滤液冷却结晶,过滤,用饱和MgSO4溶液洗涤,再用乙醇洗涤
【解析】
(1)为加快反应速率,可以采用升高温度、适当增大反应物浓度、增大反应物接触面积等方法,如适当升高温度、把硼镁泥粉碎、或搅拌、或适当增加硫酸浓度;另外所加酸过量太多,在后续操作中消耗过多的MgO,故答案为:加热/搅拌/提高酸液浓度等;避免调pH时消耗过多的MgO;
(2)“氧化”步骤主要是氧化亚铁离子,方便通过调节pH而将铁元素除去,方程式为:H2O2+2Fe2++2H+===2Fe3++2H2O;但双氧水不稳定,易分解,其中Fe3+为其分解的催化剂,因此不宜用H2O2代替Ca(ClO)2,故答案为:H2O2+2Fe2++2H+===2Fe3++2H2O、H2O2不稳定易分解或Fe3+等金属离子会催化H2O2的分解;
(3)用MgO来调节溶液的pH时,即使过量,也易通过过滤而除去,且不引入新的杂质,故答案为:防止加入的NaOH引入Na+杂质;
(4)由CaSO4和MgSO4·7H2O溶解的特点可知,宜采用冷却结晶的办法来除去CaSO4,然后用饱和MgSO4溶液洗涤除去杂质,用乙醇洗涤利于去除水分,故答案为:加热浓缩,趁热过滤;将滤液冷却结晶,过滤,用饱和MgSO4溶液洗涤,再用乙醇洗涤。

 期末集结号系列答案
期末集结号系列答案