��Ŀ����
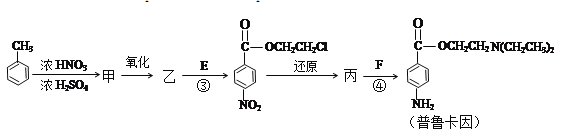
����Ŀ����֪��B������C��Hԭ�Ӹ�����Ϊ1��2����Է�������Ϊ28���˴Ź���������ʾ������ֻ��һ�ֻ�ѧ��������ԭ�ӣ��������µ�ת����ϵ��

��1��B�Ľṹ��ʽ��_________________��
��2��A��������������������__��
a���� b��±���� c���� d������
��3����Ӧ����D��HCl�����ʵ���֮��1��1�ļӳɷ�Ӧ����D�ķ���ʽ��_____________����Ӧ�ڿɱ�ʾΪ��G+NH3��F+HCl ��δ��ƽ�����÷�Ӧ��ƽ��Ļ�ѧ����ʽ��____________���л���������ýṹ��ʽ��ʾ����
������E��HOCH2CH2Cl���� F[HN��CH2CH3��2]��ҩƷ��³����ϳɵ���Ҫ�м��壬��³����ĺϳ�·�����£�����֪�� ��
��
��4���Ľṹ��ʽ��__���ɼױ����ɼķ�Ӧ������__��
��5�����������ֺ���������______����Ӧ�۵Ļ�ѧ����ʽ�ǣ�______����
��6�����й����ŵ�������______��
��7����³����������ˮ����ﶡ���죻
�������Ϊͬ���칹�壬��Ľṹ��ʽ��__��
���쾭�ۺϷ�Ӧ�Ƴɵĸ߷�����ά�㷺����ͨѶ��������þۺϷ�Ӧ�Ļ�ѧ����ʽ��__��
��D�ĺ�����ױ��������ڳ�C��H����C��C�����������C��O��������D��F��һ�������·�Ӧ���ɶ��Ļ�ѧ����ʽ��______��
���𰸡� CH2=CH2 ab C2H4O 2CH3CH2Cl+NH3��NH��CH2CH3��2+2HCl ![]() ȡ����Ӧ �Ȼ�������
ȡ����Ӧ �Ȼ������� 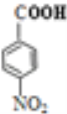 +HOCH2CH2Cl
+HOCH2CH2Cl![]()
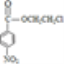 +H2O ��������ԭ�ӡ�����
+H2O ��������ԭ�ӡ����� ![]()
![]()
![]()
����������B������C��Hԭ�Ӹ�����Ϊ1:2����Է�������Ϊ28,�����ʽCnH2n,��14n=28,����ó�n=2,�˴Ź���������ʾ������ֻ��һ�ֻ�ѧ��������ԭ��,��BΪCH2=CH2��A����Ϊ±��������������ȥ��Ӧ������ϩ,B��D����������Ӧ,(3)�з�Ӧ(1)��D��HCl�����ʵ���֮��1:1�ļӳɷ�Ӧ,D���Ժ�������Һ��Ӧ����DΪCH3CHO��B��HCl�����ӳɷ�Ӧ����G��GΪCH3CH2Cl��G�백������ȡ����Ӧ����F���ݴ˽����
����³����ĺϳ�·�߿���֪��,�ױ�����������Ӧ���ɼ�Ϊ![]() ,������������Ϊ
,������������Ϊ![]() ,����E����������Ӧ����
,����E����������Ӧ����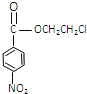 ��
��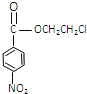 �������仹ԭΪ�������ɱ�Ϊ
�������仹ԭΪ�������ɱ�Ϊ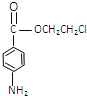 ,����F����ȡ����Ӧ������³����,Ȼ�������ʵ������������
,����F����ȡ����Ӧ������³����,Ȼ�������ʵ������������
���:(1)��������������֪��,BΪCH2=CH2 ����ˣ�������ȷ����:CH2=CH2 ��
(2)A������ȥ��Ӧ������ϩ,��A����Ϊ±����������ѡ:ab��
(3)��Ӧ(1)��D��HCl�����ʵ���֮��1:1�ļӳɷ�Ӧ,��D�ķ���ʽΪC2H4O ,��Ӧ(2)Ϊ2CH3CH2Cl+NH3��NH��CH2CH3��2+2HCl ,
��ˣ�������ȷ����:C2H4O ��2CH3CH2Cl+NH3��NH��CH2CH3��2+2HCl ��
(4)��������������֪��,��Ϊ�������ױ�,�ṹ��ʽΪ![]() ,�ɼױ����ɼķ�Ӧ������ȡ����Ӧ,��ˣ�������ȷ����:
,�ɼױ����ɼķ�Ӧ������ȡ����Ӧ,��ˣ�������ȷ����:![]() ;ȡ����Ӧ;
;ȡ����Ӧ;
(5)��Ϊ![]() �����еĹ�����Ϊ�Ȼ�����������Ӧ(3)�ķ�Ӧ��ʽΪ��
�����еĹ�����Ϊ�Ȼ�����������Ӧ(3)�ķ�Ӧ��ʽΪ��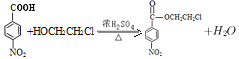 ��
��
��ˣ�������ȷ����:�Ȼ�;�Ȼ�; ��
��
��6����Ϊ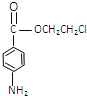 ���к��й����ŵ���������������ԭ�ӡ�������
���к��й����ŵ���������������ԭ�ӡ�������
��7������³����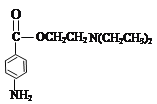 ��ˮ����������֣��ֱ��ǣ�
��ˮ����������֣��ֱ��ǣ�![]() ��
��![]() ������
������![]() ��
��![]() ��Ϊͬ���칹�壻
��Ϊͬ���칹�壻
��![]() �а������Ȼ��������۷�Ӧ������
�а������Ȼ��������۷�Ӧ������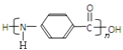 ���þۺϷ�Ӧ�Ļ�ѧ����ʽ��
���þۺϷ�Ӧ�Ļ�ѧ����ʽ�� ![]() ��
��
��D��F��һ�������·�Ӧ���ɶ��Ļ�ѧ����ʽ��![]() ��
��

����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ�������������Ϣ���ɡ�
He | |||||||||||||||||
d | e | ||||||||||||||||
a | c | ||||||||||||||||
b | |||||||||||||||||
��1������ͼ����ʵ�߲�ȫԪ�����ڱ��ı߽�_________________________
��2��д��c�����ڱ��ж�Ӧ��λ��________����������ԭ�ӽṹʾ��ͼ___________��
��3����ͬ��С��a��b����Ԫ�صĵ��ʷֱ�Ͷ��ˮ�У���Ӧ�Ͼ��ҵ���_______(�û�ѧʽ��ʾ, ��ͬ)������ˮ��Ӧ�Ļ�ѧ����ʽΪ_________��
��4���Ƚ�dԪ�غ�eԪ��ԭ�Ӱ뾶�Ĵ�С_________������>�����ӣ���
����Ŀ��Ԫ�����ڱ���Ԫ����������ѧϰ���о�������ʵ�����к���Ҫ�����á��±��г��ˢ١������Ԫ�������ڱ��е�λ�á�
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
1 | �� | �� | ||||||
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | ||||
4 | �� | �� |
��ش�
��1���ڱ�������Ԫ���У�����������Ӧ��ˮ�����У�������ǿ����________(����ѧʽ)��
��2���ڢڢۢ�����Ԫ�ص�����������Ӧ��ˮ�����У�������ǿ����_______(����ѧʽ)������ʽ��________��
��3���ߢ���γɵ���̬�⻯���У����ȶ�����________(����ѧʽ)��
��4��Ԫ�آ��⻯��Ļ�ѧʽ��________,����ʽ��________
��5����Ԫ�����Ԫ���γɵĻ�����ĵ���ʽ��________
����Ŀ��ʵ��������þ��Ϊԭ����ȡMgSO4��7H2O�ֲ�Ʒ�Ĺ������£�
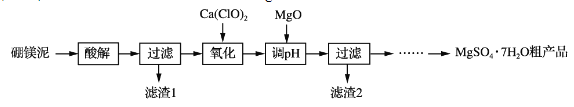
��þ�����Ҫ�ɷ����±���
MgO | SiO2 | FeO��Fe2O3 | CaO | Al2O3 | B2O3 |
30%��40% | 20%��25% | 5%��15% | 2%��3% | 1%��2% | 1%��2% |
(1)����⡱ʱΪ���Mg2���Ľ����ʣ��ɲ��õĴ�ʩ��_____(дһ��)��������˹���̫���ԭ����_____��
(2)�������������У�����H2O2����Ca(ClO)2��������Ӧ�����ӷ���ʽΪ______________��ʵ��δʹ��H2O2����H2O2�ɱ����⣬�����ܵ�ԭ����______________________________________��
(3)����pH��ʱ��MgO������NaOH��Һ��ԭ����________________________��
(4)��ϸ�����Ϣ����MgSO4��7H2O�ֲ�Ʒ(������CaSO4)�ᴿ��ȡMgSO4��7H2O��ʵ�鷽�����£����ֲ�Ʒ����ˮ��_________________________________________________����������Ȼ�ӷ����(ʵ���б���ʹ�õ��Լ��У�����MgSO4��Һ���Ҵ�)���������ε��ܽ��(g/100 gˮ)
�¶ȡ� | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4��7H2O | 30.9 | 35.5 | 40.8 | 45.6 |