题目内容
【题目】下列反应能用离子方程式:H++OH-=H2O。表示的是( )
A.CH3COOH+NaOH=CH3COONa+H2O
B.2H2SO4+Cu(OH)2=CuSO4+2H2O
C.HCl+KOH=KCl+H2O
D.HCl+NH3·H2O=NH4Cl+H2O
【答案】C
【解析】
A、CH3COOH是弱电解质,不能拆开,故该反应不能用题中的离子方程式表示;
B、Cu(OH)2不溶于水,不能拆开,故该反应不能用题中的离子方程式表示;
C、该反应可以用题中的离子方程式表示;
D、NH3·H2O是弱电解质,不能拆开,故该反应不能用题中的离子方程式表示;
故选C。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
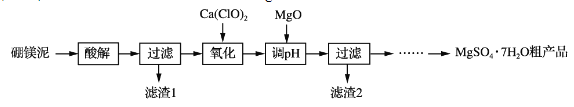
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |