题目内容
19.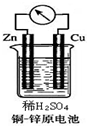 如图所示的铜-锌原电池中,理论上应观察到的现象是:
如图所示的铜-锌原电池中,理论上应观察到的现象是:铜是正极,发生还原反应,电极反应式是2H++2e-=H2↑;
锌是负极,发生氧化反应,电极反应式是Zn-2e-=Zn2+.
分析 在铜-锌原电池中,Zn比Cu活泼,Zn作负极,失电子,发生氧化反应,Cu为正极,氢离子在Cu电极上得电子,发生还原反应,根据得失电子判断电极反应现象并写出电极反应式,据此分析.
解答 解:在铜-锌原电池中,Zn比Cu活泼,Zn作负极,失电子,发生氧化反应,电极反应式为:Zn-2e-=Zn2+,Cu为正极,氢离子在Cu电极上得电子,发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:正极;还原反应;2H++2e-=H2↑;负极;氧化反应;Zn-2e-=Zn2+.
点评 本题考查了原电池的正负极的判断及电极反应式的书写等知识点,写电极反应式时要注意电解质溶液的成分,题目难度不大.

练习册系列答案
相关题目
10.有一多肽其化学式为C55H70O19N10,将其彻底水解后只得到下列四种氨基酸:
甘氨酸(H2N-CH2COOH),丙氨酸(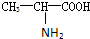 ),苯丙氨酸(
),苯丙氨酸(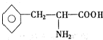 )
)
谷氨酸(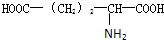 ),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )
),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )
甘氨酸(H2N-CH2COOH),丙氨酸(
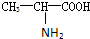 ),苯丙氨酸(
),苯丙氨酸( )
)谷氨酸(
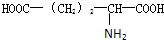 ),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )
),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )| A. | 10,4,3 | B. | 10,3,4 | C. | 9,4,3 | D. | 9,3,4 |
14.R的气态氢化物为RH3,则R元素最高价氧化物的水化物的化学式可能是( )
| A. | H3RO4 | B. | H2RO4 | C. | HRO4 | D. | H2RO3 |
4.下列离子方程式书写正确的是( )
| A. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO | |
| C. | NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
11.相同物质的量的下列各烃,完全燃烧后消耗氧气最多的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 乙炔 |
8.有一种AB2C2型分子,在该分子中以A为中心原子.下列有关它的分子构型和有关同分异构体的说法正确的是( )
| A. | 假若为平面四边形,则有三种同分异构体 | |
| B. | 假若为四面体,则有两种同分异构体 | |
| C. | 假若为平面四边形,则无同分异构体 | |
| D. | 假若为四面体,则无同分异构体 |
9.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1L0.1mol/LNa2CO3溶液中,阴离子总数大于0.1NA | |
| B. | 常温常压下,1mol甘氨酸中含C-H键数目为3NA | |
| C. | 标准状况下,6.72LNO2与水充分反应转移电子数目为0.1NA | |
| D. | 50℃时,10LpH=13的NaOH溶液中含有的OH-数目为NA |
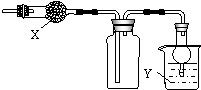 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )