题目内容
下列事实不能用平衡移动原理解释的是
| A.钢铁在潮湿的空气中比在干燥空气中更容易生锈 |
| B.用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 |
| C.蒸馏水和0.1 mol?L-1 NaOH溶液中的c(H+),前者大于后者 |
| D.向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去 |
A
解析试题分析:A、钢铁在潮湿的空气中更易形成原电池,发生电化学腐蚀,所以钢铁在潮湿的空气中比在干燥空气中更容易生锈,这属于金属腐蚀,与化学平衡无关,正确;B、AlCl3溶液中铝离子水解生成氢氧化铝和氯化氢,加热使水解平衡正向移动,且生成的氯化氢易挥发,因此,平衡一直右移,最终生成的氢氧化铝受热分解得氧化铝,不能得无水氯化铝,与化学平衡有关,错误;C、蒸馏水中c(H+)为1.0×10-7 mol/L,而0.1 mol?L-1NaOH溶液中的c(H+)为1.0×10-13mol/L,因为氢氧化钠溶液中的氢氧根离子浓度增大,使水的电离平衡逆向移动,c(H+)减小,与化学平衡移动有关,错误;D、Fe3+水解生成氢氧化铁和氢离子,加入MgCO3,与氢离子反应生成二氧化碳,使水解平衡中的氢离子浓度减小,水解平衡正向移动,生成氢氧化铁沉淀,可过滤除去,与化学平衡移动有关,错误,答案选A。
考点:考查与化学平衡移动有关的事实判断

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y 2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )
A. ×100% ×100% | B. ×100% ×100% | C. ×100% ×100% | D. ×100% ×100% |
CO(g)+H2O(g)  ?H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
?H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
| A.加入催化剂,加快了反应速率,反应的ΔH也随之改变 |
| B.温度降低,正、逆反应速率都减小,反应放出的热量不变 |
| C.恒容时充入稀有气体或充入H2,正、逆反应速率都减小 |
| D.改变压强,反应速率发生改变,反应放出的热量不变 |
下列有关说法错误的是
| A.为保护海轮的船壳,常在船壳上镶入锌块 |
| B.纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应 |
| C.已知工业合成氨气△H<0,达平衡后,升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| D.NH3(g) + HCl(g)="=" NH4Cl(s)较低温度下能自发进行,说明该反应的△H<0 |
下列叙述表示可逆反应N2 + 3H2 2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( )
| A.N2、H2、NH3的百分含量相等 | B.3v(N2)正= v(H2)逆 |
| C.定容容器中,气体的密度不变 | D.N2、H2、NH3的浓度之比为1:3:2 |
硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应
2SO2 + O2 2SO3的说法中正确的是
2SO3的说法中正确的是
| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 |
| C.若用18O原子组成的O2参加反应,平衡时SO2中也会含有18O |
| D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
对于在恒温恒容容器中进行的反应A(g)+2B(g)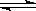 3C(g)+D(g),以下不能说明已达平衡状态的是
3C(g)+D(g),以下不能说明已达平衡状态的是
| A.反应容器中,压强不随时间改变而改变 |
| B.单位时间内生成3nmolC的同时生成nmolA |
| C.反应容器中,混合气体的平均相对分子质量不再改变 |
| D.反应容器中的气体密度不随时间变化 |
下列有关说法正确的是
| A.CaCO3(s) =CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| C.N2(g)+3H2(g) =2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大 |
| D.水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 |
下列说法不正确的是
A.在固定体积的密闭容器中发生可逆反应A(s)+B(g)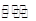 C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态 C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态 |
B.对于反应C(s)+CO2(g)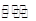 2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率也一定增大 2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率也一定增大 |
C.向0.1mol·L-1的NH3·H2O中加入氯化铵固体,则溶液中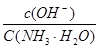 增大 增大 |
D.常温下向Mg(OH)2悬浊液中加入MgCl2浓溶液后,溶液中 不变 不变 |