题目内容
对于在恒温恒容容器中进行的反应A(g)+2B(g)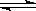 3C(g)+D(g),以下不能说明已达平衡状态的是
3C(g)+D(g),以下不能说明已达平衡状态的是
| A.反应容器中,压强不随时间改变而改变 |
| B.单位时间内生成3nmolC的同时生成nmolA |
| C.反应容器中,混合气体的平均相对分子质量不再改变 |
| D.反应容器中的气体密度不随时间变化 |
D
解析试题分析:A、恒温恒容容器中,随反应的进行,压强一直在变化,达平衡时,压强不再变化,正确;B、生成3nmolC的同时生成nmolA,是两个可逆的反应方向,且符合化学计量数之比,符合正逆反应速率相等,正确;C、该反应的气体的物质的量在变化,质量不变,所以气体的平均相对分子质量在变,达平衡时,不再变化,正确;D、恒容容器,体积不变,气体质量不变,所以密度始终不变,错误,答案选D。
考点:考查对化学平衡的状态的判断

练习册系列答案
相关题目
下列事实不能用平衡移动原理解释的是
| A.钢铁在潮湿的空气中比在干燥空气中更容易生锈 |
| B.用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 |
| C.蒸馏水和0.1 mol?L-1 NaOH溶液中的c(H+),前者大于后者 |
| D.向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去 |
一定条件下,可逆反应N2 + 3H2 2NH3达到化学平衡状态,下列说法一定正确的是
2NH3达到化学平衡状态,下列说法一定正确的是
| A.每1 mol N≡N断裂的同时有2 mol N—H生成 |
| B.N2、H2、NH3的浓度之比为1:3:2 |
| C.N2减少的速率和NH3减少的速率之比为1:2 |
D.气体体积为初始体积的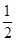 |
T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为: ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
A.该反应可表示为X(g) + 2Y(g) 2Z(g) + 2W(g) 2Z(g) + 2W(g) |
| B.减小X浓度,平衡向逆反应方向移动,平衡常数K减小 |
| C.增大反应容器的压强,该反应速率一定增大 |
| D.升高温度,W(g)体积分数增加,则正反应是放热反应 |
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量的6 mol·L-1的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
加热N2O5时,发生以下两个反应:N2O5 N2O3 + O2,N2O3
N2O3 + O2,N2O3 N2O + O2。在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol?L-1,c(N2O3) 为1.62mol?L-1,则c(N2O5) 为( )
N2O + O2。在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol?L-1,c(N2O3) 为1.62mol?L-1,则c(N2O5) 为( )
| A.1.44mol?L-1 | B.3.48mol?L-1 | C.0.94mol?L-1 | D.1.98mol?L-1 |
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是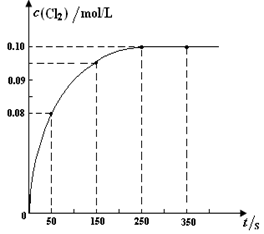
| A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s) |
| B.该温度下,反应的平衡常数K = 0.025 |
| C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0 |
| D.反应达平衡后,再向容器中充入1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L |
 2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是
2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是