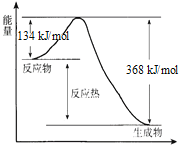
题目内容
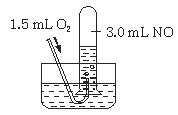
【题目】下列实验操作中,溶液里无固体析出的是( )
A.MgCl2溶液中加入Na的小颗粒B.饱和Ca(OH)2溶液中加入Na的小颗粒
C.CuSO4溶液中加入Na的小颗粒D.水中加入Na的小颗粒
【答案】D
【解析】
钠和水反应生成氢氧化钠和氢气。
A.氢氧化钠和氯化镁发生反应生成氢氧化镁沉淀和氯化钠,A不选;
B.Na与水反应产生NaOH和氢气,反应消耗水,使溶剂的质量减少,导致溶液成为过饱和溶液,会析出部分氢氧化钙固体,B不选;
C.CuSO4和氢氧化钠发生复分解反应生成氢氧化铜沉淀,C不选;
D.钠和水反应生成氢氧化钠和氢气,没有固体析出,D选;
故合理选项是D。

【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为了回收利用含钢催化剂(V2O5、VOSO4及不溶性杂质),科研人员最新研制了一种离子交换法回收钒的新工艺。该工艺的主要流程如图所示:
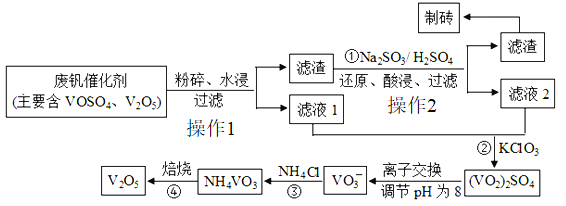
已知:部分含钒物质在水中的溶解性:
物质 | V2O5 | VOSO4 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 可溶 | 难溶 | 易溶 |
(1)由V2O5冶炼金属钒采用铝热剂法,反应的化学方程式为:___________
(2)V2O5通常用作为反应2SO2+O2![]() 2SO3的理想催化剂,其催化的机理可能是加热时可逆地失去氧的原因,其过程可用两个化学方程式表示:_________、4V+5O2
2SO3的理想催化剂,其催化的机理可能是加热时可逆地失去氧的原因,其过程可用两个化学方程式表示:_________、4V+5O2![]() 2V2O5.
2V2O5.
(3)反应①的目的是_________.
(4)将滤液1与滤液2混合后用氯酸钾氧化,氯元素被还原为最低价,其反应的离子方程式为______.
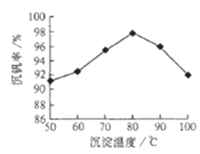
(5)反应③的沉淀率(又称沉钒率) 是回收钒的关键之一,下图是反应温度与沉钒率的关系图,则控制温度的方法是____________.
(6)反应④在NH4VO3的焙烧过程中,固体质量的减少值(纵坐标) 随温度变化的曲线如图2所示,则其分解过程中_______(填字母代号)。
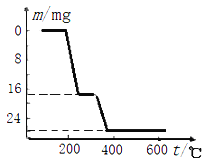
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3, 再分解失去H2O
C.同时分解失去H2O 和NH3
D.同时分解失去H2和N2和H2O
(7)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+![]() VO2++H2O+V3+。电池充电时阳极的电极反应式为__________
VO2++H2O+V3+。电池充电时阳极的电极反应式为__________
【题目】硼、铝属元素周期表IIIA短周期元素。回答下列问题:
(1)基态B原子的价电子轨道表达式为__________,其第一电离能比Be ________(填“大”或“小”)。
(2)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,能体现配位键的结构式为__________,与氨硼烷互为等电子体的烃的分子式为__________。
(3)插图 | (4)插图 | (5)插图 |
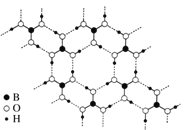
(3)常温常压下硼酸晶体为结构层状,其二维平面结构如图所示:
硼酸的化学式为__________,B原子的杂化类型为_______。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:_____________________________________。
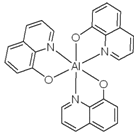
(4)8-羟基喹啉铝是一种黄色粉末,它是OLED中的重要发光材料及电子传输材料,其微观结构如图所示,8-羟基喹啉铝中存在的化学键为______________。
A.金属键 B.极性键 C.非极性键 D.配位键 E.π键
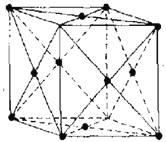
(5)金属铝晶体中原子呈面心立方紧密堆积(如上图)。该晶胞空间利用率为_________________(用含π的代数式表示);铝的密度是2.7gcm-3,阿伏伽德罗常数为NA,依此可计算出Al原子半径r(Al)=__________cm.