题目内容
【题目】硼、铝属元素周期表IIIA短周期元素。回答下列问题:
(1)基态B原子的价电子轨道表达式为__________,其第一电离能比Be ________(填“大”或“小”)。
(2)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,能体现配位键的结构式为__________,与氨硼烷互为等电子体的烃的分子式为__________。
(3)插图 | (4)插图 | (5)插图 |
(3)常温常压下硼酸晶体为结构层状,其二维平面结构如图所示:
硼酸的化学式为__________,B原子的杂化类型为_______。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:_____________________________________。
(4)8-羟基喹啉铝是一种黄色粉末,它是OLED中的重要发光材料及电子传输材料,其微观结构如图所示,8-羟基喹啉铝中存在的化学键为______________。
A.金属键 B.极性键 C.非极性键 D.配位键 E.π键
(5)金属铝晶体中原子呈面心立方紧密堆积(如上图)。该晶胞空间利用率为_________________(用含π的代数式表示);铝的密度是2.7gcm-3,阿伏伽德罗常数为NA,依此可计算出Al原子半径r(Al)=__________cm.
【答案】 ![]() 小
小 ![]() C2H6 H3BO3 sp2 氢键使硼酸“缔合”成层状“大分子”,故不易溶于水;加热破坏了氢键使“大分子”解离,溶解度增大 BCDE
C2H6 H3BO3 sp2 氢键使硼酸“缔合”成层状“大分子”,故不易溶于水;加热破坏了氢键使“大分子”解离,溶解度增大 BCDE ![]()
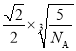
【解析】(1). B原子的价电子分布为2S2SP1,其电子排布图为![]() ,在一个轨道中,最多仅能容纳2个电子,它们的自旋状态相反,用↑↓表示;根据“洪特规则”,等价轨道全满为稳定结构,所以B的第一电离能小于Be。
,在一个轨道中,最多仅能容纳2个电子,它们的自旋状态相反,用↑↓表示;根据“洪特规则”,等价轨道全满为稳定结构,所以B的第一电离能小于Be。
(2)NH3与BH3均为0化合价,NH3给出孤对电子, BH3提供空轨道接受电子对形成了![]() 结构;很明显,乙烷C2H6与氨硼烷互为等电子体;
结构;很明显,乙烷C2H6与氨硼烷互为等电子体;
(3)每个单元中B为2/3,O为2,H为2,故分子式为H3BO3;B与3个O原子杂化得到三个夹角为120°的平面三角形杂化轨道,为sp2杂化;加热时,硼酸分子间氢键断裂,所以硼酸在冷水中的溶解度小而加热时溶解度增大;
(4)A. 金属键主要存在于金属晶体中,所以此结构中不存在金属键,A错误;B. 结构中H原子与其他原子形成的共价键为极性键,B正确;C. 碳原子间形成的共价键为非极性键,C正确;D. 铝具有空轨道与N(具有孤对电子)形成配位键,D正确;E. 因为苯环中含有π键,所以8-羟基喹啉铝中含有π键,E正确。故选择BCDE。
(5)在面心立方最密堆积的晶胞中,面对角线长度是原子半径的4倍。则晶胞边长为2![]() r ,晶胞体积V晶胞=16
r ,晶胞体积V晶胞=16![]() 。面心立方堆积的晶胞上占有的原子数为8×
。面心立方堆积的晶胞上占有的原子数为8×![]() +6×
+6×![]() =4,原子占有的体积为V原子 = 4×
=4,原子占有的体积为V原子 = 4×![]() πr3 。晶胞的空间利用率等于V原子/V晶胞 =
πr3 。晶胞的空间利用率等于V原子/V晶胞 =![]() =
= ![]() .
.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案



