题目内容
【题目】在400℃、101 kPa时,NO2(g) +CO(g) ![]() NO(g) + CO2(g) 反应过程的能量变化如下图所示。
NO(g) + CO2(g) 反应过程的能量变化如下图所示。
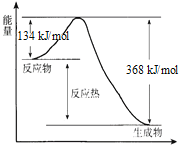
反应过程
(1)该反应是_____________(填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为_____________。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是_____________。
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?____(填“是”或“否”),原因是____。
【答案】 放热 NO2(g)+CO(g)![]() NO(g)+CO2(g) △H= -234 kJ·mol-1 d 否 催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响
NO(g)+CO2(g) △H= -234 kJ·mol-1 d 否 催化剂只能改变化学反应的速率和途径,不能改变化学反应始态和终态的能量,因此对反应热没有影响
【解析】(1)从图中明显得到反应物能量高于生成物能量,所以反应是放热反应。
(2)从图中看出反应物和生成物的能量差为134-368=-234;所以反应△H= -234 kJ·mol-1,需要注意的问题是:题目要求反应所处的环境为400℃,所以要求标出该测定的条件。
(3)能够改变反应活化能的条件只能是催化剂。
(4)对于一个确定的反应而言,实际上能影响反应焓变的只有方程式中的物质系数和物质状态,除此之外都不会影响焓变。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
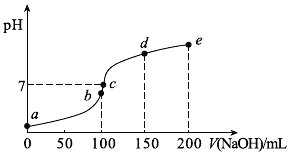
浙江之星学业水平测试系列答案【题目】我国农业生产因遭受酸雨而造成的损失每年高达15亿元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。某实验小组采集硫酸型酸雨样品,随着时间的推移,多次测定该样品的pH,得到了表中数据:(已知pH越小,溶液的酸性越强)
时间(h) | 0 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)酸雨样品放置时pH变化的主要原因是(用化学方程式表示)____________________。
(2)如果将刚取样的上述酸雨和自来水混合,pH将________(填“增大”“减小”或“不变”),原因是(用化学方程式表示)____________________。
(3)你认为减少酸雨产生可采取的措施是___________(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤