题目内容
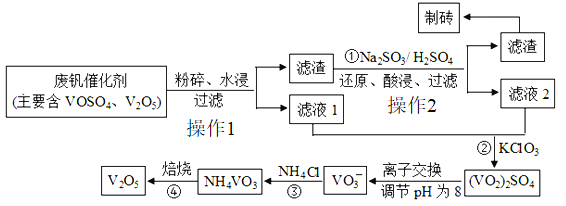
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为了回收利用含钢催化剂(V2O5、VOSO4及不溶性杂质),科研人员最新研制了一种离子交换法回收钒的新工艺。该工艺的主要流程如图所示:
已知:部分含钒物质在水中的溶解性:
物质 | V2O5 | VOSO4 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 可溶 | 难溶 | 易溶 |
(1)由V2O5冶炼金属钒采用铝热剂法,反应的化学方程式为:___________
(2)V2O5通常用作为反应2SO2+O2![]() 2SO3的理想催化剂,其催化的机理可能是加热时可逆地失去氧的原因,其过程可用两个化学方程式表示:_________、4V+5O2
2SO3的理想催化剂,其催化的机理可能是加热时可逆地失去氧的原因,其过程可用两个化学方程式表示:_________、4V+5O2![]() 2V2O5.
2V2O5.
(3)反应①的目的是_________.
(4)将滤液1与滤液2混合后用氯酸钾氧化,氯元素被还原为最低价,其反应的离子方程式为______.
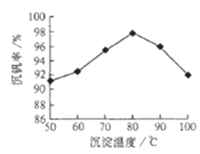
(5)反应③的沉淀率(又称沉钒率) 是回收钒的关键之一,下图是反应温度与沉钒率的关系图,则控制温度的方法是____________.
(6)反应④在NH4VO3的焙烧过程中,固体质量的减少值(纵坐标) 随温度变化的曲线如图2所示,则其分解过程中_______(填字母代号)。
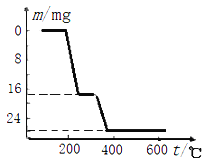
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3, 再分解失去H2O
C.同时分解失去H2O 和NH3
D.同时分解失去H2和N2和H2O
(7)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+![]() VO2++H2O+V3+。电池充电时阳极的电极反应式为__________
VO2++H2O+V3+。电池充电时阳极的电极反应式为__________
【答案】 3V2O5+10Al![]() 6V+5A12O3 5SO2+V2O5
6V+5A12O3 5SO2+V2O5![]() 5SO3+2V 将V2O5转化为可溶性的VOSO4 C1O3 -+6VO2++3H2O=6VO2++6H++C1- 将反应容器置于80℃的水浴中 B VO2++H2O-e- =VO2++2H+
5SO3+2V 将V2O5转化为可溶性的VOSO4 C1O3 -+6VO2++3H2O=6VO2++6H++C1- 将反应容器置于80℃的水浴中 B VO2++H2O-e- =VO2++2H+
【解析】(1)高温下,用金属铝从活泼性比铝差的金属氧化物中置换出该金属,既为铝热剂法;正确答案:3V2O5+10Al![]() 6V+5A12O3。
6V+5A12O3。
(2)用2SO2+O2![]() 2SO3反应减去4V+5O2
2SO3反应减去4V+5O2![]() 2V2O5反应,消去氧气,即可得到第一个反应的方程式;正确答案:5SO2+V2O5
2V2O5反应,消去氧气,即可得到第一个反应的方程式;正确答案:5SO2+V2O5![]() 5SO3+2V。
5SO3+2V。
(3) 根据题给信息,V2O5 不溶于水,因此在酸性条件下,用亚硫酸钠把 V2O5还原为可溶性的VOSO4,便于氯酸钾把VOSO4氧化为(VO2)2SO4;正确答案:将V2O5转化为可溶性的VOSO4 。
(4) 易溶于水VOSO4被氧化为易溶的(VO2)2SO4,而氯酸钾中氯元素被还原到Cl-;正确答案: C1O3 -+6VO2++3H2O=6VO2++6H++C1-。
(5)从图像中看出,温度为80℃时,沉钒率最高,因此可以用水浴加热进行操作;正确答案:将反应容器置于80℃的水浴中。
(6)由图像中曲线变化可知:200℃时左右时,固体质量大约减少17克,应该为氨气的质量;400℃左右时,固体质量大约又减少18克,应该为水的质量;所以NH4VO3在焙烧过程中200℃时左右先失去氨;在400℃左右再失去水,最终NH4VO3在焙烧发生分解反应,最终产物为V2O5、NH3和H2O;正确答案:B。
(7)充电过程为电解的过程,阳极发生氧化反应,VO2+中钒为+4价,氧化为+5价的VO2+;正确答案:VO2++H2O-e- =VO2++2H+。

【题目】我国农业生产因遭受酸雨而造成的损失每年高达15亿元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。某实验小组采集硫酸型酸雨样品,随着时间的推移,多次测定该样品的pH,得到了表中数据:(已知pH越小,溶液的酸性越强)
时间(h) | 0 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)酸雨样品放置时pH变化的主要原因是(用化学方程式表示)____________________。
(2)如果将刚取样的上述酸雨和自来水混合,pH将________(填“增大”“减小”或“不变”),原因是(用化学方程式表示)____________________。
(3)你认为减少酸雨产生可采取的措施是___________(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤