题目内容
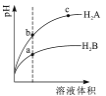
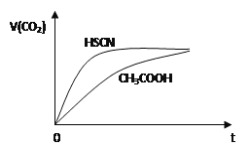
【题目】【江西省师大附中、临川一中2017届高三1月联考理综】等体积浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液混合,①、②分别与③混合,实验测得产生的CO2气体体积(V)随时间(t)的变化如图所示,下列说法正确的是( )
A. 三种溶液pH的比较③>②>①
B. 反应结束后所得两溶液中,c(CH3COO-)>c(SCN-)
C. 上述三种溶液中水电离的电离度:NaHCO3>CH3COOH>HSCN
D. ①与③反应所得的溶液中:c(CH3COO-) + c(CH3COOH) = 0.1mol/L
【答案】C
【解析】
NaHCO3溶液呈碱性,PH〉7,HSCN与NaHCO3反应先完成,速率快,说明HSCN中H+浓度大于CH3COOH中H+浓度,酸性大,则PH小,三种溶液pH的③>①>②,A错误。HSCN酸性大于CH3COOH,SCN-水解程度小于CH3COO-,则溶液中c(SCN-)>c(CH3COO-),B错误。NaHCO3可水解,促进水的电离,CH3COOH、HSCN为酸,均抑制水的电离,HSCN酸性大于CH3COOH,HSCN抑制能力大 ,水的电离程度小,水电离的程度:NaHCO3>CH3COOH>HSCN,C正确。等体积浓度CH3COOH溶液与NaHCO3溶液混合,体积变为2倍,根据物料守恒有:c(CH3COO-) + c(CH3COOH) = 0.05mol/L,D错误。

练习册系列答案
相关题目