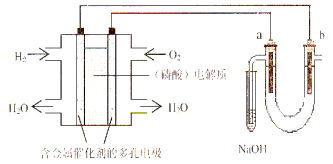
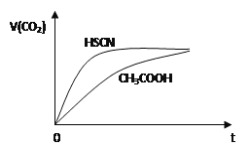
题目内容
【题目】【陕西省榆林市2017届高考模拟第一次测试理综】常温下,各取1mL PH=2的两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
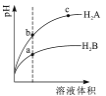
A. H2A的酸性比H2B弱
B. c点溶液的导电性比a,b点溶液的导电性都强
C. 若0.1mol/LNaHA溶液的PH=4,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A) >c(H+)>c(OH-)
D. Na2B的水溶液中,离子浓度大小为试卷c(Na+)>c(B2-)>c(OH-)>c(H+)
【答案】D
【解析】A.弱酸中存在电离平衡,加水稀释促进弱酸电离,稀释时,如果是强酸,则溶液的pH增大多,弱酸pH增大的少,所以H2A的酸性比H2B强,故A错误;B.溶液中氢离子浓度越大,导电性越强,a点的pH最小,氢离子浓度最大,所以a点溶液的导电性最强,故B错误;C.若0.1molL-1NaHA溶液的PH=4,溶液显酸性,HA-的电离程度大于水解程度,则c(A2-)>c(H2A),所以离子浓度大小为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A),故C错误;D.H2B为弱酸,Na2B的水溶液显碱性,则溶液中离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+),故D正确;故选D。

【题目】下表中物质的分类组合完全正确的是
编 号 | A | B | C | D |
强电解质 | KNO3 | H2SO4 | Ba(OH)2 | BaSO4 |
弱电解质 | CH3COOH | CaCO3 | H2S | NH3·H2O |
非电解质 | SO2 | CO2 | Cl2 | C2H5OH溶液 |
A. A B. B C. C D. D
【题目】(11分)下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ||||||
(1)①—⑦元素中金属性最强的元素位于周期表第 周期 族。
(2)可作为半导体材料的是 (写元素符号)。
(3)表中元素⑥的原子结构示意图为 。
(4)④与⑤形成的常见化合物的化学键的类型为 ,该化合物的电子式为 。
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 。