题目内容
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
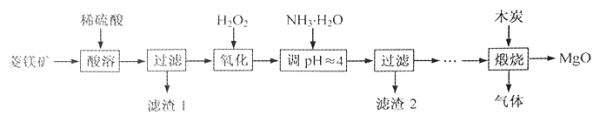
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分布吸收或收集。
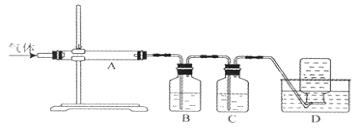
①D中收集的气体是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a.NaOH溶液 B.Na2CO3溶液 C.稀硝酸 D.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
【答案】(1)MgCO3+2H+=Mg2++CO2↑+H2O(2分)
(2)2FeSO4 +H2O2+H2SO4 =Fe2(SO4)3 +2H2O(2分)
(3)Fe(OH)3 (2分)
(4)①CO(2分)②d(2分)③3S+6OH-![]() 2S2-+SO32-+3H2O(2分)
2S2-+SO32-+3H2O(2分)
【解析】
试题分析:菱镁矿的主要成分为MgCO3,含少量FeCO3,根据上述流程图,向菱镁矿中加入稀硫酸,FeCO3、MgCO3均会反应,生成FeSO4 和MgSO4 ,过滤除去不与硫酸反应的杂质,再加入H2O2 ,目的是将FeSO4 氧化成Fe2(SO4)3 ,加入氨水调节pH=4将Fe3+ 变成Fe(OH)3 沉淀,得到滤渣2从而除去,之后将MgSO4 溶液蒸干得到MgSO4 固体,再用木炭还原法制备高纯氧化镁,据此回答。
(1)MgCO3是难溶电解质,书写离子方程式时不能拆开,所以MgCO3与稀硫酸反应的离子方程式为MgCO3+2H+=Mg2++CO2↑+H2O。
(2)根据上述分析,加入H2O2的目的是将FeSO4 氧化成Fe2(SO4)3,反应的化学方程式为2FeSO4 +H2O2+H2SO4 =Fe2(SO4)3 +2H2O。
(3)加氨水调节溶液的PH的目的是使铁元素沉淀而镁不能沉淀,铁元素在溶液中以铁离子形式存在,所以滤渣2的成分是Fe(OH)3。
(4)①右图装置对煅烧产生的气体进行分步吸收或收集,所以最终的剩余气体为CO,即D中收集的气体是CO。
②反应产生的气体产物有SO2、CO2、CO,三种气体分步被吸收或收集,SO2、CO2都能与a、b反应,与c都不能反应,而高锰酸钾溶液可与SO2反应,所以B中应放高锰酸钾溶液吸收SO2,答案选d。
③淡黄色固体为S,与热的NaOH溶液发生歧化反应,S被氧化为SO32-,同时被还原成S2-,其离子方程式为3S+6OH-![]() 2S2-+SO32-+3H2O。
2S2-+SO32-+3H2O。

 阅读快车系列答案
阅读快车系列答案【题目】下表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空。
族 周期 | ⅠA | 0 | ||||||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
2 | X | Y | G | |||||||||||
3 | Z | …… | H | W | E | Q | ||||||||
(1)上述元素的原子中,得电子能力最强的是______________(填元素名称)。
2)化学性质最不活泼的是___________(填元素符号)。
(3)G对应离子的半径______________Z对应离子的半径(填“<”或“>”)。
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:________________。
(5)元素X的最高价氧化物的电子式________________,元素W的最高价氧化物为
_______________(填晶体类型)。
(6)为比较元素X和W的非金属性强弱,用下图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B的作用是________________,能说明X和W非金属性强弱的化学方程式是_________________________________。

【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)