题目内容
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。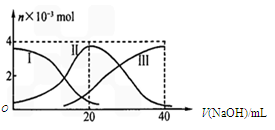
根据图示判断,下列说法正确的是
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合,其溶液中水的电离程度比纯水的大
C.向Na2A溶液加入水的过程中,pH可能增大也可能减小
D.NaHA溶液中:c(OH-)+c(A2-) = c(H+)+c(H2A)
AD
解析试题分析:A、此时物质恰好反应生成NaHA,图中读出c(HA-)>c(A2-)> c(H2A)知NaHA电离大于水解,以电离为主,故有c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),正确;B、此时同A选项,NaHA电离溶液为酸性抑制水的电离,错误;C、Na2A溶液水解呈碱性,加水稀释离子浓度减少,pH减小,错误;D、质子守恒,正确。
考点:考查溶液中离子浓度关系有关问题。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
下列有关说法正确的是
| A.常温下,0.1 mol·L-1 CH3COOH溶液的pH=1 |
| B.铅蓄电池在放电过程中,负极质量增加,正极pH减少 |
| C.反应CO2(g)+C(s)=2CO(g)在低温下不能自发进行,则其△H>0 |
| D.常温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小 |
现有浓度均为0.1mol·L-1三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
100℃时,下列各溶液中,离子的物质的量浓度关系正确的是:
| A.pH=11的氨水中:c(OH-)=3.0mol·L-1 |
| B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)=c(CH3COO-) |
| C.pH=2的稀盐酸中,c(H+)=c(Cl-) |
| D.pH=8的Na2SO3溶液中,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) |
下列说法正确的是
| A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大 |
| B.1 mol·L-1的NH4Cl溶液中含有NH4+的数目一定小于NA |
| C.用石墨电极电解FeCl3溶液,阴极反应:2Fe3++6H2O+6e-=2Fe(OH)3↓+3H2↑ |
| D.将带有相反电荷的胶体混合,一定会出现胶体聚沉现象 |
T℃时,CaCO3和CaF2的Ksp分别为1.0 ×10-10。和4.0 ×10-12。下列说法正确的是
| A.T℃时,两饱和溶液中c(Ca2+ ):CaCO3>CaF2 |
| B.T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C.T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D.T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是 
| A.两条曲线间任意点均有c(H+)·c(OH-)=Kw |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |
(6分)(2012?广东)对于常温下pH为2的盐酸,传述正确的是( )
| A.c(H+)=c(Cl﹣)+c(OH﹣) |
| B.与等体积pH=12的氨水混合后所得溶液显酸性 |
| C.由H2O电离出的c(H+)=1.0×10﹣12 mol?L﹣1 |
| D.与等体积0.01 mol?L﹣1乙酸钠溶液混合后所得溶液中:c(Cl﹣)=c(CH3COO﹣) |
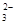 )+c(HCO
)+c(HCO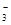 )]
)]