题目内容
现有浓度均为0.1mol·L-1三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
C
解析试题分析:溶液①为单一的醋酸溶液,所以溶液中有CH3COO-、H+、OH- 3种离子,因此A选项不满足电荷守恒,A错误;溶液①、②等体积混合,则酸碱恰好完全中和生成醋酸钠,但是由于等体积混合,体积增大,得到的c(CH3COO- )< 0.1mol·L-1 ,但是由于物料守恒,所得溶液有c(CH3COO-)+c(CH3COOH) = c(Na+),所以B错误,C正确;溶液①、③等体积混合,溶液呈酸性,因此c(H+)> c(OH-),而c(Na+)< c(CH3COO-),所以D错误,故选C。
考点:本题考查的是混合溶液 中离子浓度大小比较。

练习册系列答案
相关题目
常温下,将VL0.10mol·L-1盐酸和VL0.06mol·L-1Ba(OH)2溶液混合后,该混合液的pH为(设混合后总体积为2VL)
| A.1.7 | B.12.3 | C.12 | D.2 |
下列说法正确的是
| A.常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③ (NH4)2Fe(SO4)2三种溶液中水的电离程度:③>②>① |
B.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)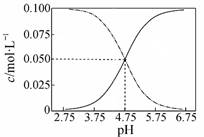 |
| C.向Ca(OH)2溶液中加入过量的NaHCO3溶液: Ca2++2HCO3-+2OH-→ CO32-+CaCO3↓+2H2O |
| D.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系: Kw ·K = Ka |
室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是 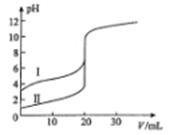
| A.II表示的是滴定醋酸的曲线 |
| B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL |
| C.V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-) |
| D.V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-) |
室温下,对于醋酸及其盐的下列判断正确的是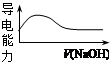
| A.稀醋酸溶解石灰石的离子方程式为 CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大 |
| C.向稀醋酸中加入等浓度的NaOH溶液,导电能力变化如右图 |
| D.CH3COONH4溶液和K2SO4溶液均显中性,两溶液中水的电离程度相同 |
下列说法正确的是
| A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
现有常温下的五种溶液(如下表)。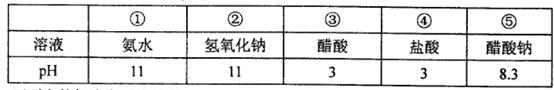
下列有关叙述中正确的是
| A.五种溶液中,水电离出的c(OH-)最小的是⑤ |
| B.将①、④两种溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)> c(OH-)。 |
| C.分别将①、②、③、④加水稀释100倍,稀释后四种溶液的pH:①>②>③>④ |
| D.在⑤中加入适量的④至溶液呈中性,所得溶液中:c(Na+)>c(CH3COO-)> c(Cl-)>c(OH-)= c(H+)。 |
常温下,将0.01 mol·L-1 Na2SO3溶液与0.01 mol·L-1 KHSO3溶液等体积混合,若忽略混合后溶液的体积的变化,则下列判断正确的量( )
| A.混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-) |
| B.混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-) |
| C.混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol/L |
| D.两溶液混合前,Na2SO3溶液中,水电离出C(H+)小于KHSO3溶液中水电离出C(H+) |