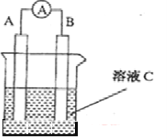
题目内容
【题目】(14分)工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:

(1)滤渣A经CS2提取后可获得一种淡黄色副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
【答案】(1)S;(2)做氧化剂;
(3)4Fe2+ + O2 + 6H2O = 4FeOOH↓ + 8H+ 增大空气与溶液的接触面积,加快反应速率。
(4)Zn(锌);(5)60℃条件下蒸发浓缩、降温结晶(每空2分,共12分)。
【解析】
试题分析:(1)滤渣A经CS2提取后可获得一种淡黄色副产品,其化学式S;(2)浸取过程中Fe2(SO4)3的作用是作氧化剂,把还原性的物质氧化;(3)除铁过程控制溶液的pH在5.4左右,这时会发生沉淀反应,形成FeOOH沉淀,根据流程图中的物质可知:该反应的离子方程式为4Fe2+ + O2 + 6H2O = 4FeOOH↓ + 8H+;该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是增大空气与溶液的接触面积,加快反应速率。(4)除去杂质的原则是不增不减,即不增加新的杂质,不减少被提纯的物质本身,由于在溶液中主要含有ZnSO4,所以置换法除重金属离子所用物质C为Zn;(5)根据ZnSO4的溶解度表可知ZnSO4的溶解度随温度的升高而增大,在60/℃时最高,所以从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为60℃条件下蒸发浓缩、降温结晶。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】下表为元素周期表的一部分,请回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是________和________。
(2)表中最活泼的金属最高价氧化物的水化物化学式是________,非金属性最强的元素单质化学式是________ ,表中能形成两性氢氧化物的元素对应最高价氧化物化学式是_______ 。
(3)分别写出④元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:_____________________,_________________________。
(4)可以比较⑦与⑩单质氧化性的离子方程式为:_______________________。
(5)表中形成化合物种类最多的元素的元素符号是______,形成的种类繁多的这类化合物中,最简单的化合物的化学式是________。
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/mol·L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在1020 min内,以物质A表示的平均反应速率为______mol·L-1,50min时,v(正)_____(填“<” “>” 或“=”)v(逆)。
(2)020 min内,实验2比实验1的反应速率________(填“快”或“慢”),其原因可能是__________。
(3)实验3比实验1的反应速率____________(填“快”或“慢”),其原因是_______________。