题目内容
19.常温下,体积相同,浓度均为0.1mol/L的苯酚钠、碳酸氢钠、碳酸钠、醋酸钠四种溶液pH最大的是( )| A. | 苯酚钠溶液 | B. | 碳酸氢钠溶液 | C. | 碳酸钠溶液 | D. | 醋酸钠溶液 |
分析 弱酸的酸性越弱,对应酸根离子的水解程度越大,其盐溶液的碱性越强,pH越大,据此分析.
解答 解:弱酸的酸性越弱,对应酸根离子的水解程度越大,其盐溶液的碱性越强,pH越大,酸性:醋酸>碳酸>苯酚>碳酸氢根离子,
则水解程度:碳酸根离子>苯酚离子>碳酸氢根离子>醋酸根离子,所以碳酸钠溶液的碱性最强,PH最大;
故选C.
点评 本题考查学生弱电解质的电离以及盐的水解知识,注意弱离子水解程度规律:越弱越水解,题目难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
9.有机物分子中原子之间(或原子与原子团之间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 乙醇不能与NaOH溶液反应,苯酚则能跟NaOH溶液反应 | |
| B. | 乙醛一定条件下能与氢气发生加成反应,乙酸一般不能与氢气发生加成反应 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,甲苯则能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
10.用锌片与1mol•L-1稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是( )
| A. | 对该反应体系加热 | B. | 加入少量NaCl溶液 | ||
| C. | 不用锌片,改用锌粉 | D. | 加入少量1 mol•L-1硫酸 |
7.核外电子层结构相同的一组微粒是( )
| A. | Mg2+、Al3+、Cl-、Ne | B. | Na+、F-、S2-、Ar | ||
| C. | K+、Ca2+、S2-、Ar | D. | Mg2+、Na+、Cl-、S2- |
4.合成结构简式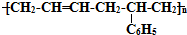 的高聚物,其单体是( )
的高聚物,其单体是( )
①苯乙烯 ②丁烯 ③1,3-丁二烯 ④丙炔 ⑤苯丙烯.
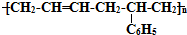 的高聚物,其单体是( )
的高聚物,其单体是( )①苯乙烯 ②丁烯 ③1,3-丁二烯 ④丙炔 ⑤苯丙烯.
| A. | ①② | B. | ④⑤ | C. | ③⑤ | D. | ①③ |
11.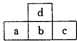 如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )
如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )
 如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )
如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )| A. | a、b、c的最高价氧化物对应水化物的酸性强弱关系为c>b>a | |
| B. | d的氢化物比b的氢化物稳定 | |
| C. | 非金属性:c>b>a | |
| D. | 原子半径:c>b>a>d |
8.下列说法正确的是( )
| A. |  的名称为2-乙基丙烷 的名称为2-乙基丙烷 | |
| B. | CH2═CHCH3不能发生取代反应 | |
| C. | 新戊烷与Br2发生一取代生成两种有机物 | |
| D. | 2-甲基-1,3-丁二烯与等物质的量的Br2发生加成反应的产物有3种 |
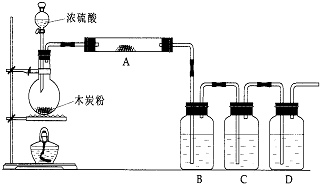
 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O