题目内容
11.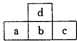 如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )
如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )| A. | a、b、c的最高价氧化物对应水化物的酸性强弱关系为c>b>a | |
| B. | d的氢化物比b的氢化物稳定 | |
| C. | 非金属性:c>b>a | |
| D. | 原子半径:c>b>a>d |
分析 由元素在短周期中的位置可知,d处于第二周期,a、b、c处于第三周期,a原子最外层的电子数比次外层的电子数少3,最外层电子数为5,则a为P元素,可推知b为S、c为Cl、d为O.
A.同周期自左而右非金属性增强,非金属性越强最高价氧化物对应水化物的酸性越强;
B.非金属性越强氢化物越稳定;
C.同周期自左而右非金属性增强;
D.同周期自左而右原子半径减小,电子层越多原子半径越大.
解答 解:由元素在短周期中的位置可知,d处于第二周期,a、b、c处于第三周期,a原子最外层的电子数比次外层的电子数少3,最外层电子数为5,则a为P元素,可推知b为S、c为Cl、d为O.
A.同周期自左而右非金属性增强,故非金属性a<b<c,非金属性越强最高价氧化物对应水化物的酸性越强,故最高价氧化物对应水化物的酸性c>b>a,故A正确;
B.非金属性O>P,非金属性越强氢化物越稳定,故d的氢化物比a的氢化物稳定,故B正确;
C.同周期自左而右非金属性增强,故非金属性c>b>a,故C正确;
D.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径P>S>Cl>O,即a>b>c>d,故D错误;
故选D.
点评 本题考查结构位置性质关系,侧重对元素周期律的考查,比较基础,注意对元素周期律的理解掌握.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
19.常温下,体积相同,浓度均为0.1mol/L的苯酚钠、碳酸氢钠、碳酸钠、醋酸钠四种溶液pH最大的是( )
| A. | 苯酚钠溶液 | B. | 碳酸氢钠溶液 | C. | 碳酸钠溶液 | D. | 醋酸钠溶液 |
6.下列烷烃的一氯代物中没有同分异构体的是( )
| A. | 丁烷 | B. | 丙烷 | C. | 乙烷 | D. | 2-甲基丙烷 |
16.下列烷烃进行一氯取代反应后,只能生成三种沸点不同的产物是( )
| A. | CH3CH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH2CH(CH3)2 | D. | (CH3)3C(CH2)2CH3 |
10.下列叙述正确的是( )
| A. | 聚丙烯的结构简式为: | B. | 氯化氢的电子式为: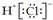 | ||
| C. | 甲烷的比例模型: | D. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl |
 我国国家标准( GB2760 )规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
我国国家标准( GB2760 )规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.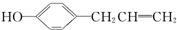
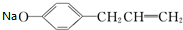 +H2O;
+H2O;