题目内容
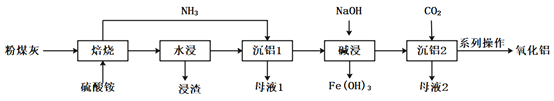
【题目】已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大。A单质是密度最小的气体。B是周期表已知元素中非金属性最强的元素,且和C属同一主族。D、E、F属同一周期,D、F为主族元素,又知E、F的原子序数分别是29、33。D跟B可形成离子化合物,其晶胞结构如图:

(1)比C元素质子数少1的原子的价层电子的轨道表示式为__________。
(2)E元素在周期表中第_____周期,第_____族的元素,它的+2价离子的电子排布式为________。写出E的单质与稀硝酸反应的离子方程式___________。
(3)F元素的名称是_____。与F同一主族的第二、三周期元素与A形成的化合物沸点的高低为___________>__________(用化学式表示),判断的理由____________。
(4)写出D跟A形成的化合物的电子式为________。
【答案】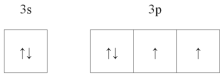 四 ⅠB 1s22s22p63s23p63d9(或[Ar]3d9) 3Cu+8H++2
四 ⅠB 1s22s22p63s23p63d9(或[Ar]3d9) 3Cu+8H++2![]() =3Cu2++NO↑+4H2O 砷 NH3 PH3 NH3可以形成分子间氢键,沸点高
=3Cu2++NO↑+4H2O 砷 NH3 PH3 NH3可以形成分子间氢键,沸点高 ![]()
【解析】
根据题目所给条件,A单质是密度最小的气体,则A为H元素;B是周期表已知元素中非金属性最强的元素,则B为F元素;C与B同主族且A、B、C、D、E、F的原子序数依次增大,则C为Cl元素;E、F的原子序数分别是29、33,则E为Cu元素,F为As元素;D跟B可形成如图所示的晶胞结构,晶胞中D占有8个顶点和6个面心,则晶胞中含有![]() =4个D,8个B全部晶胞内部,则该粒子化合物为DB2,因D为主族元素且原子序数大于Cl小于Cu,则D为Ca元素,据此分析。
=4个D,8个B全部晶胞内部,则该粒子化合物为DB2,因D为主族元素且原子序数大于Cl小于Cu,则D为Ca元素,据此分析。
(1)比Cl元素质子数少1的原子为S原子,其价电子数为6,根据电子排布规则,S原子基态价电子轨道表示式为 ;
;
(2)E为Cu元素,其在元素周期表中的位置为第四周期第ⅠB族,其+2价离子为Cu2+,电子排布式为1s22s22p63s23p63d9(或[Ar]3d9);Cu与稀硝酸反应的离子方程式为3Cu+8H++2![]() =3Cu2++NO↑+4H2O;
=3Cu2++NO↑+4H2O;
(3)F的元素名称为砷,与其同主族的第二、三周期元素为N、P,氢化物为NH3、PH3,因NH3可以形成分子间氢键,故NH3的沸点高于PH3;
(4)Ca与H两种元素形成的化合物为离子化合物,化学式为CaH2,其中Ca最外层的两个电子分别转移到2个H上,Ca形成+2价离子,H形成-1价离子,故CaH2的电子式为![]() 。
。

 阅读快车系列答案
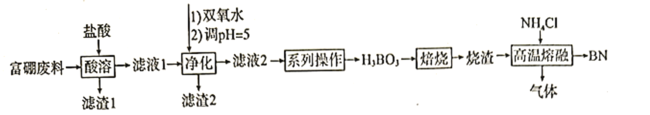
阅读快车系列答案【题目】氮化硼![]() 广泛应用于制造合金、耐高温材料和半导体。科研小组以富硼废料(主要成分为
广泛应用于制造合金、耐高温材料和半导体。科研小组以富硼废料(主要成分为![]() 和
和![]() ,还含有少量
,还含有少量![]() 等)为原料,制备氮化硼的一种工艺流程如下:
等)为原料,制备氮化硼的一种工艺流程如下:
已知:硼酸溶于水和乙醇,在水中的溶解度如下
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度( | 2.77 | 4.78 | 8.90 | 14.89 | 23.54 | 39.60 |
回答下列问题:
(1)“酸溶”时需控制适当温度,温度不能过高的原因为____________________________;除控制适当温度外,可加快“酸溶”速率的措施还有__________________(答出一点即可)。
(2)“净化”时第一步反应的化学方程式为__________________;第二步调![]() 的目的为_______________;滤液2中
的目的为_______________;滤液2中![]() _______________(已知
_______________(已知![]() )
)
(3)“系列操作”中,洗涤结晶出来的硼酸的操作为__________________________。
(4)“高温熔融”过程中生成的气体为两种氢化物,则主要反应的化学方程式为__________________________;生成的气体用水吸收后可返回__________________________工序循环利用。