题目内容
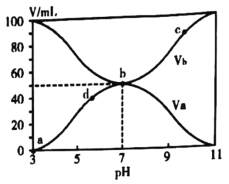
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb和的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是( )
A.HX为弱酸
B.b点:![]()
C.b→c点过程中存在:![]()
D.c、d两点: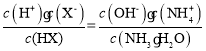 值相等
值相等
【答案】C
【解析】
据图可知Va增大pH减小,所以Va表示HX的体积,Vb表示NH3·H2O的体积。
A.由图可知0.1mol/L的HX溶液的pH=3,所以HX为弱酸,故A正确;
B.因为b点的pH=7,结合电荷守恒![]() 可知
可知![]() ,根据物料守恒
,根据物料守恒![]() ,所以
,所以![]() 故B正确;
故B正确;
C.b→c点过程中存在电荷守恒![]() ,因为b→c点过程中溶液显碱性,所以
,因为b→c点过程中溶液显碱性,所以![]() ,所以
,所以![]() ,故C错误;
,故C错误;
D.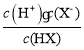 为HX的电离平衡常数,
为HX的电离平衡常数, 为NH3·H2O电离平衡常数;b点加入等体积、等浓度的HX和氨水,两者恰好完全反应生成NH4X,b点溶液的pH=7,说明Xˉ与
为NH3·H2O电离平衡常数;b点加入等体积、等浓度的HX和氨水,两者恰好完全反应生成NH4X,b点溶液的pH=7,说明Xˉ与![]() 的水解程度相等,所以二者电离平衡常数相等,故D正确;
的水解程度相等,所以二者电离平衡常数相等,故D正确;
故答案为C。

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目