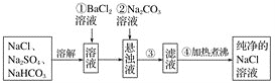
题目内容
【题目】煤炭燃烧发电副产物可用于提取高纯度氧化铝,其工艺流程如下:
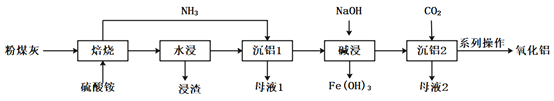
已知:粉煤灰的主要成份是Al2O3,主要杂质是SiO2、Fe2O3。
“焙烧”的主要反应:Fe2O3+4(NH4)2SO4=2NH4Fe(SO4)2+6NH3↑+3H2O Al2O3+4(NH4)2SO4=2NH4Al(SO4)2+6NH3↑+3H2O 回答下列问题:
(1)“浸渣”的主要成分为________(填化学式)。
(2)“沉铝1”中生成含铝元素沉淀的离子方程式是________。
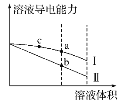
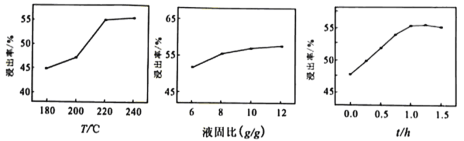
(3)结合下图分析“碱浸”时最优条件是________(填序号)。
A、200℃、8g/g、1.0h B、200℃、10g/g、1.5h C、220℃、10g/g、1.0h D、220℃、12g/g、1.5h
(4) “沉铝2”发生反应的离子方程式为________。
(5)流程中“一系列操作”是________。
(6)流程中可循环利用的物质是________。(填化学式)
(7)用1t含铝10.8%的粉煤灰,制得高纯度Al2O3 80kg,其产率为________%(结果保留1位小数)。
(8)传统工艺流程中第一步是将粉煤灰用硫酸“酸浸”脱硅,与之相比硫酸铵法的优点是________。
【答案】SiO2 Al3++3NH3H2O=Al(OH)3↓+3NH4+ C CO2+[Al(OH)4]=Al(OH)3↓+HCO3 洗涤、灼烧 (NH4)2SO4 39.2 硫酸铵可循环利用,对设备的腐蚀比硫酸小
【解析】
粉煤灰的主要成份是Al2O3,主要杂质是SiO2、Fe2O3,加入硫酸铵焙烧,分别发生Fe2O3+4(NH4)2SO4![]() 2NH4Fe(SO4)2+6NH3↑+3H2O,Al2O3+4(NH4)2SO4
2NH4Fe(SO4)2+6NH3↑+3H2O,Al2O3+4(NH4)2SO4![]() 2NH4Al(SO4)2+6NH3↑+3H2O,水浸得到的滤渣为SiO2,生成的氨气通入滤液中生成氢氧化铝、氢氧化铁,加入氢氧化钠,可生成[Al(OH)4]-,过滤除去氢氧化铁,在滤液中通入二氧化碳,可生成氢氧化铝,经过滤、洗涤、干燥,灼烧可生成氧化铝,以此解答该题。
2NH4Al(SO4)2+6NH3↑+3H2O,水浸得到的滤渣为SiO2,生成的氨气通入滤液中生成氢氧化铝、氢氧化铁,加入氢氧化钠,可生成[Al(OH)4]-,过滤除去氢氧化铁,在滤液中通入二氧化碳,可生成氢氧化铝,经过滤、洗涤、干燥,灼烧可生成氧化铝,以此解答该题。
(1)由以上分析可知“浸渣”的主要成分为SiO2,
故答案为:SiO2;
(2)“沉铝Ⅰ”中生成含铝元素沉淀的离子方程式是Al3++3NH3H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(3)由图象可知“碱浸”时最优条件是220℃、10g/g、1.0h,
故答案为:C;
(4)“沉铝2”发生反应的离子方程式为CO2+[Al(OH)4]=Al(OH)3↓+HCO3,
故答案为:CO2+[Al(OH)4]=Al(OH)3↓+HCO3;
(5)由氢氧化铝得到氧化铝,应经洗涤,然后灼烧,
故答案为:洗涤、灼烧;
(6)母液1中含有硫酸铵,可循环利用,
故答案为:(NH4)2SO4;
(7)用1t含铝10.8%的粉煤灰,m(Al)=108kg,理论可制得氧化铝的质量为![]() ×
×![]() ×102kg=204kg,而实际制得高纯度Al2O380kg,其产率为
×102kg=204kg,而实际制得高纯度Al2O380kg,其产率为![]() ×100%=39.2%,
×100%=39.2%,
故答案为:39.2;
(8)该流程中硫酸铵可循环利用,对设备的腐蚀比硫酸小,
故答案为:硫酸铵可循环利用,对设备的腐蚀比硫酸小。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】已知反应![]() 是可逆反应。设计如图装置(
是可逆反应。设计如图装置(![]() 均为石墨电极),分别进行下述操作:
均为石墨电极),分别进行下述操作:
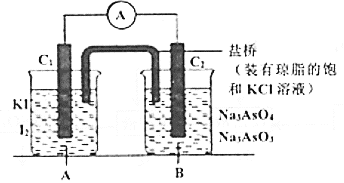
①向B烧杯中逐滴加入浓盐酸。②向B烧杯中逐滴加入![]() 溶液。结果发现电流表指针均发生偏转。
溶液。结果发现电流表指针均发生偏转。
(1)①过程中![]() 棒上发生的反应为_________;
棒上发生的反应为_________;
②过程中![]() 棒上发生的反应为___________。
棒上发生的反应为___________。
(2)操作②过程中,盐桥中的![]() 移向_________烧杯溶液(填“A”或“B”)。
移向_________烧杯溶液(填“A”或“B”)。
资料:![]() 。向
。向![]() 一定浓度的
一定浓度的![]() 溶液中加入
溶液中加入![]() 溶液,达平衡后,相关微粒浓度如下:
溶液,达平衡后,相关微粒浓度如下:
微粒 |
|
|
|
浓度 |
|
| a |
(3)a=________________。该平衡体系中除了含有![]() 和
和![]() 外,判断溶液是否一定还含有其他含碘微粒______________(填“是”或“否”)。
外,判断溶液是否一定还含有其他含碘微粒______________(填“是”或“否”)。
(4)已知:甲醇与水蒸气重整制氢可直接用于燃料电池。
反应:![]()
反应:![]()
则![]() ______________
______________![]()
(5)已知:25℃时,![]() 。医学上进行消化系统的X射线透视时,常使用
。医学上进行消化系统的X射线透视时,常使用![]() 作内服造影剂。胃酸酸性很强(pH约为1),但服用大量
作内服造影剂。胃酸酸性很强(pH约为1),但服用大量![]() 仍然是安全的,
仍然是安全的,![]() 不溶于酸的原因是(用溶解平衡原理解释):_________。误服少量
不溶于酸的原因是(用溶解平衡原理解释):_________。误服少量![]() ,应尽快用大量的一定浓度的
,应尽快用大量的一定浓度的![]() 溶液给患者洗胃,忽略洗胃过程中
溶液给患者洗胃,忽略洗胃过程中![]() 溶液浓度的变化,要使残留在胃液中的
溶液浓度的变化,要使残留在胃液中的![]() 浓度为
浓度为![]() ,应服用的
,应服用的![]() 溶液的最低浓度为_______
溶液的最低浓度为_______![]() 。
。