题目内容
c(H+)相等的盐酸和醋酸溶液都稀释相同的倍数后,pH的大小关系是( )
| A、盐酸>醋酸 | B、醋酸>盐酸 |
| C、盐酸=醋酸 | D、无法判断 |
考点:pH的简单计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:醋酸为弱电解质,溶液中存在电离平衡,加水稀释后醋酸的电离程度增大,溶液中氢离子浓度物质的量增大;
氯化氢为强电解质,溶液中完全电离,加水稀释后氢离子的物质的量基本不变,根据c=
可知,二者稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,再根据溶液中氢离子浓度越大,溶液的pH越小进行判断.
氯化氢为强电解质,溶液中完全电离,加水稀释后氢离子的物质的量基本不变,根据c=
| n |
| V |
解答:
解:醋酸是弱酸,加水后醋酸电离程度增大,溶液中氢离子的物质的量增大;而盐酸是强酸,在水中完全电离,加水后,氢离子浓度只是减小,所以c(H+)相等的盐酸和醋酸溶液都稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,溶液中氢离子浓度越大,溶液pH越小,则溶液的pH大小为:盐酸>醋酸,
故选A.
故选A.
点评:本题考查了溶液pH的计算、弱电解质的电离平衡及其影响,题目难度不大,注意掌握溶液的pH的概念及计算方法,明确弱电解质的电离及其影响因素.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
在25℃的条件下,下列叙述正确的是( )
| A、将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)=c(NH4+) |
| B、pH=3的醋酸溶液,稀释至原体积的10倍后pH=4 |
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7 |
| D、向0.1mol?L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)增大 |
各取1mol下列物质(除苯环外,分子内不含其他类环)与浓溴水充分反应,消耗Br2的物质的量按①②顺序排列正确的是( )
①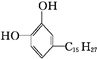 ②
②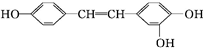
①
 ②
②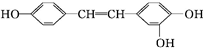
| A、2mol、6mol |
| B、5mol、6mol |
| C、4mol、5mol |
| D、3mol、6mol |
下列反应的离子方程式正确的是( )
| A、将氢碘酸加到Fe(OH)3胶体中:Fe(OH)3+3H+═Fe3++3H2O |
| B、碳酸氢钙溶液中中入少量烧碱:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O |
| C、新制氯水中滴入少量溴化亚铁溶液:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、锌与1mol/L-1 HNO3溶液反应:Zn+2H+═Zn2++H2↑ |
下列离子方程式书写正确的是( )
| A、将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-═Fe3++2H2O+NO↑ |
| B、Fe(OH)3与足量的HI溶液反应:Fe(OH)3+3H+═Fe3++3H2O |
| C、漂白粉溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D、向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3?H2O+H2O |
下列说法可以证明反应:N2+3H2
2NH3已达平衡状态的是( )
| 催化剂 |
| 高温、高压 |
| A、一个N≡N键断裂的同时,有3个H-H键形成 |
| B、N2、H3、NH3的分子数之比为1:3:2 |
| C、一个N≡N键断裂的同时,有6个N-H键形成 |
| D、N2、H2、NH3的浓度不再变化 |
今年举国上下倡导“全民节约,共同行动”,节约用水是其中重要的一项,水是一种重要的资源,关于水的下列说法错误的是( )
| A、水是一种极弱的电解质 |
| B、水的离子积可表示KW=c(H+)?c(OH-) |
| C、常温下水呈中性:即c(H+)=c(OH-) |
| D、升高温度,c(H+)增大,显弱酸性 |
下列说法正确的( )
| A、提纯粗苯甲酸的实验中,加热溶解后,除去不溶性杂质时应充分冷却后过滤 |
| B、分子式为C4H8O2的有机物能在酸性条件下水解成两种产物,其中一种产物能被氧化成另一种产物,则符合条件的有机物有3种 |
| C、沸点比较:1,2,3-丙三醇>乙二醇>丙烷>乙醇>乙烷 |
| D、在碱性条件下,将0.1mol的CH3COO18C2H5完全水解,所得乙醇分子中氧原子内含中子的物质的量为1mol |