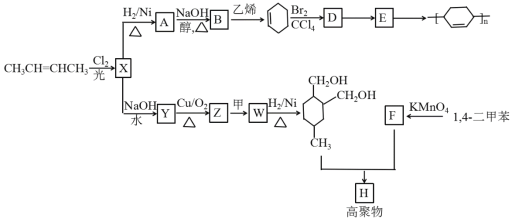
题目内容
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是
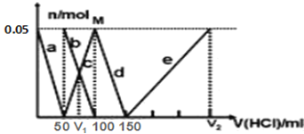
A. a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O
B. M点时生成的CO2为0.05mol
C. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
D. V1∶V2=1∶4
【答案】D
【解析】
酸性强弱顺序为:![]() ,因此a曲线表示AlO2-的减少情况,发生的反应为
,因此a曲线表示AlO2-的减少情况,发生的反应为![]() ;b曲线表示
;b曲线表示![]() 逐渐减少的情况,发生的反应为
逐渐减少的情况,发生的反应为![]() ,同时c曲线表示
,同时c曲线表示![]() 逐渐增多;曲线d表示
逐渐增多;曲线d表示![]() 减少的情况,发生的反应为
减少的情况,发生的反应为![]() ;曲线e表示
;曲线e表示![]() 逐渐增多,发生的反应为
逐渐增多,发生的反应为![]() 。
。
A项,根据上述分析可知a曲线表示的离子方程式为:![]() ,故A项错误;
,故A项错误;
B项,c曲线表示![]() 逐渐增多,M点处全部转化为
逐渐增多,M点处全部转化为![]() ,并无
,并无![]() 气体产生,故B项错误;
气体产生,故B项错误;
C项,根据反应方程式![]() 、
、![]() ,且图中参与反应的浓度为
,且图中参与反应的浓度为![]() 的盐酸体积均为50mL,可知原混合溶液中的
的盐酸体积均为50mL,可知原混合溶液中的![]() 和
和![]() 的物质的量均为0.05mol,因此原混合溶液中的
的物质的量均为0.05mol,因此原混合溶液中的![]() 和
和![]() 的物质的量之比为1:1,故C项错误;
的物质的量之比为1:1,故C项错误;
D项,由b、c曲线关于y方向轴对称可知![]() ,根据反应
,根据反应![]() 和铝元素守恒可知,氢氧化铝消耗的盐酸的体积为150mL,所以
和铝元素守恒可知,氢氧化铝消耗的盐酸的体积为150mL,所以![]() ,所以
,所以![]() ,故D项正确;
,故D项正确;
综上所述,本题正确答案为D。

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目