题目内容
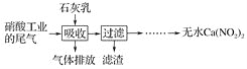
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是( )
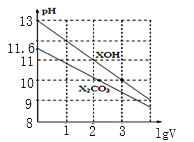
A.XOH是弱碱
B.pH=10的溶液中c(X+):XOH大于X2CO3
C.CO32-的水解常数Kh1约为1.0×10-3.8
D.当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且![]() 减小
减小
【答案】C
【解析】
A.根据图知,0.1mol/L的XOH的pH=13,说明XOH溶液中c(OH)=c(XOH),XOH完全电离,为强碱,A错误;
B.XOH是强碱溶液、X2CO3是强碱弱酸盐溶液,要使两种溶液的pH相等,则c(XOH)<c(X2CO3),XOH和X2CO3完全电离时得到c(X+):XOH小于X2CO3,B错误;
C.0.10mol/LX2CO3溶液的pH=11.6,则该溶液中:c(OH)=c(HCO3)=![]() =102.4mol/L,c(CO32)=0.1mol/L,根据Kh1=[
=102.4mol/L,c(CO32)=0.1mol/L,根据Kh1=[![]() =
=![]() =103.8,C正确;
=103.8,C正确;
D.当lgV=2时,则溶液的体积变为原来的100倍,升高温度,促进水解,第一步水解程度远远大于第二步,所以溶液中c(CO32)减小,c(HCO3)增大,即![]() 增大,D错误;故答案为:C。
增大,D错误;故答案为:C。

练习册系列答案
相关题目