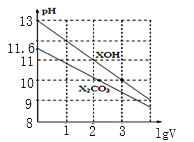
题目内容
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A.标准状况下,22.4 L H2O所含的分子数为NA
B.分子总数为NA的SO2和CO2混合气体中含有的氧原子数为2NA
C.1L一氧化碳气体一定比1L氧气的质量小
D.常温常压下8gO3中含有8NA个电子
【答案】B
【解析】
A.标况下,水不是气体,不能使用标况下的气体摩尔体积计算22.4L水的物质的量,故A错误;
B.分子总数为NA的物质的量为1mol,结合SO2和CO2混合气体中都含有2个氧原子计算,混合气体中含有的氧原子数为2NA,故B正确;
C.同温同压下,1L一氧化碳气体与1L氧气的物质的量相等,根据m=nM可知,质量与摩尔质量成正比,一氧化碳的摩尔质量比氧气的摩尔质量小,则一氧化碳的质量比氧气小,题中未指明两种气体的状态是否相同,所以不能得出准确的结论,故C错误;
D. 8gO3的物质的量为![]() mol,而1mol中含有24mol的电子,所以常温常压下8gO3中含有4NA个电子,故D错误;
mol,而1mol中含有24mol的电子,所以常温常压下8gO3中含有4NA个电子,故D错误;
答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
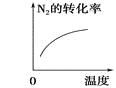
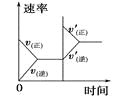
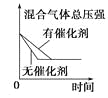
小学生10分钟应用题系列答案【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D
【题目】在800℃时,在2L密闭容器中将一定量的NO和O2混合发生反应,n(NO)随时间的变化如下表:
时间/S | 0 | 10 | 20 | 30 | 40 | 50 |
n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
请回答下列问题:
(1)用O2表示从0~20s内该反应的速率为___________。
(2)若升温到850℃,平衡后n(NO)= n(NO2),则该反应是______热反应(填:“吸”、“放”)
(3)若改变某一条件,达新平衡时n(NO)= 0.06 mol,下列说法正确的是_______。
A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.可能是缩小了容器的体积
(4)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式_________。
(5)等温时,a、b容器开始体积相等,各充入2molNO和1molO2,平衡时NO的转化率a___b(填“大于”“小于”“等于”)