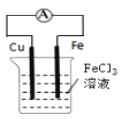
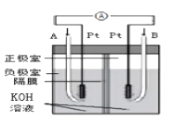
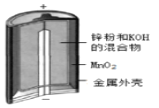
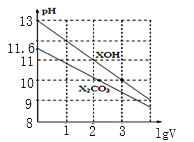
题目内容
【题目】高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图。已知当溶液的pH大于6.5,Fe2+开始转化成Fe(OH)2。

(1)步骤Ⅰ中过滤所得滤渣的主要成分是____,工业上可以利用一种弱酸溶解该物质,该弱酸为____。
(2)步骤Ⅱ中加入铁粉的目的是____。
(3)写出步骤Ⅳ中反应的离子方程式____。
(4)在空气中煅烧FeCO3可制备高纯氧化铁,煅烧所需的主要仪器为____(写一种仪器名称),FeCO3在煅烧前应充分洗涤干净,写出实验室洗涤沉淀的方法____。
(5)写出煅烧FeCO3可制备高纯氧化铁反应的化学方程式:____。
【答案】SiO2 HF 将Fe3+还原为Fe2+ Fe2++2HCO3-=FeCO3↓+H2O+CO2↑ 坩埚 将沉淀放置于漏斗的滤纸上,加蒸馏水浸没沉淀,静止让水全部滤干,重复2-3次 4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
【解析】
由流程图可知,Fe2O3、Fe3O4、FeO与足量盐酸反应生成氯化铁、氯化亚铁,SiO2不溶于盐酸,过滤后,滤液A中含有氯化铁、氯化亚铁;滤液A中加入足量铁粉,氯化铁被还原为氯化亚铁,滤液B中只含氯化亚铁,加入碳酸氢铵后生成FeCO3沉淀,高温煅烧得高纯氧化铁。
(1)Fe2O3、Fe3O4、FeO与足量盐酸反应生成氯化铁、氯化亚铁,SiO2不溶于盐酸,所以步骤Ⅰ中过滤所得滤渣的主要成分是SiO2;HF可以和SiO2反应生成四氟化硅和水,所以工业上可以用HF溶解SiO2;
(2)铁粉与氯化铁反应生成氯化亚铁,所以加入铁粉的目的是为了将Fe3+还原为Fe2+;
(3)步骤Ⅳ反应是是氯化亚铁和碳酸氢铵反应生成FeCO3沉淀、二氧化碳和水,反应的离子方程式为Fe2++2HCO3-=FeCO↓+H2O+CO↑;
(4)实验室煅烧固体所用主要仪器是坩埚;沉淀洗涤的基本操作是将沉淀放置于漏斗中的滤纸上,加蒸馏水浸没沉淀,静止让水全部自然滤干,重复2-3次;
(5)煅烧FeCO3时,FeCO3和氧气反应生成氧化铁和二氧化碳,反应的化学方程式为4FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。

 字词句篇与同步作文达标系列答案
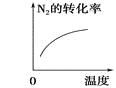
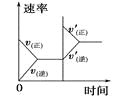
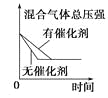
字词句篇与同步作文达标系列答案【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D