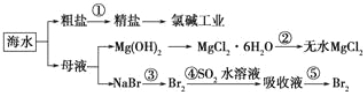
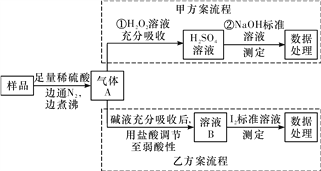
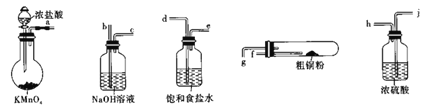
题目内容
【题目】某废液是用稀硝酸腐蚀锌板后得到的 ,某化学兴趣小组拟用该废液(含有少量的Cl-、Fe3+)制取Zn(NO3)2·6H2O的过程如下:
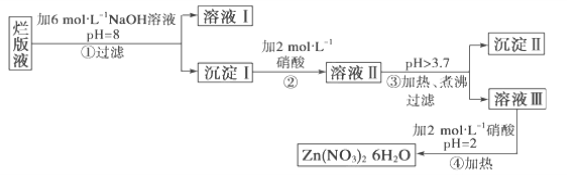
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物Zn(OH)2具有两性,Fe3+在PH=3.7时就能完全沉淀。
(1)该废液溶质的主要成分是________(填化学式)。
(2)在操作①中保持pH=8的目的是______________________。
(3)沉淀Ⅰ的成分是___________________________。
(4)操作③中加热、煮沸的目的是________________________;
(5)操作④保持pH=2的目的是__________________________;
【答案】(1)Zn(NO3)2(2)防止生成的Zn(OH)2沉淀被溶解
(3)Zn(OH)2和Fe(OH)3(4)促进Fe3+完全水解
(5)抑制Zn2+水解为Zn(OH)2
【解析】
试题分析:(1)废液中溶质的主要成分是Zn(NO3)2;
(2)使锌离子完全转化为氢氧化锌,PH不大,如果PH加大氢氧化锌两性又溶解;
(3)Zn2+、Fe3+完全沉淀生成相应的氢氧化物,即为Fe(OH)3和Zn(OH)2;
(4)因为温度越高,水解程度越大,所以加热煮沸促使Fe3+完全水解;
(5)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,则操作④保持pH=2的目的是抑制Zn2+水解为Zn(OH)2。

【题目】某学生用中和滴定法测定某烧碱样品的纯度。先准确称量10.0g含有少量中性易溶杂质的样品,配成500mL待测溶液。用0.200mol/L的盐酸标准液滴定待测液,滴定时用酚酞做指示剂。试根据实验回答下列问题:
(1)下列有关滴定操作的顺序正确的是
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.③⑤②①④ D.②①③⑤④
(2)用标准的盐酸滴定待测的NaOH溶液时,一手握酸式滴定管的活塞,一手摇动锥形瓶,眼睛注视_________,本实验滴定达到终点的标志是_________________________。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是 ,烧碱样品的纯度是___________
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前刻度(mL) | 滴定后刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
第三次 | 10.00 | 0.20 | 24.20 |
(4)若该实验修改成“用待测碱液滴定盐酸标准液”,则下列操作会使烧碱样品纯度偏高的是
A.锥形瓶用蒸馏水洗净后,先用盐酸标准液润洗再装标准液。
B.碱式滴定管用蒸馏水洗净后未润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前仰视碱式滴定管读数,滴定后俯视滴定管读数