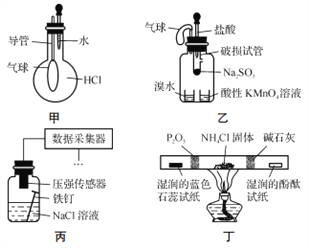
题目内容
【题目】亚硫酸盐是一种常见食品添加剂,为检验某食品中亚硫酸盐含量,某研究小组设计了如下两种实验流程:
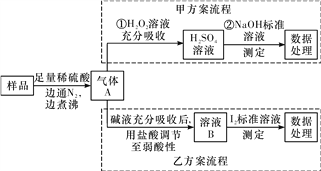
(1)气体A的主要成分是________(填化学式),加热煮沸时必须先向烧瓶中加入碎瓷片,其目的是______________________;边通入N2边煮沸的目的是________________。
(2)写出甲方案第①步反应的离子方程式:________________________。
(3)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果______(填“偏高”、“偏低”或“无影响”)。
(4)若亚硫酸盐为Na2SO3,取样品w g,按乙方案测得消耗0.0100 mol·L-1I2溶液V mL,则样品中含Na2SO3的质量分数是__________(用含w、V的代数式表示)。
【答案】 SO2 防止加热煮沸时暴沸 将生成的SO2全部赶出 SO2+H2O2===2H++SO![]() 无影响 1.26V×10-3/w
无影响 1.26V×10-3/w
【解析】(1)亚硫酸盐与稀硫酸反应生成气体SO2,为防止液体加热时暴沸,一般可加入碎瓷片;由于装置中会有残留的SO2,所以边通入N2边煮沸的目的是将生成的SO2全部赶出;(2)SO2具有还原性,可被氧化剂H2O2所氧化,反应的离子方程式为SO2+H2O2=SO42-+2H+;(3)用盐酸代替硫酸,生成的SO2气体中混有少量HCl,因SO2用碱液吸收后需再用盐酸调节溶液至弱酸性,因此混合气体中含有HCl,对实验结果无影响;(5)反应的离子方程式为H2O+SO32-+I2=SO42-+2H++2I-,则SO2~SO32-~I2,需要碘的物质的量是0.01000molL-1×V×10-3L=10-5mol,所以样品中含Na2SO3的质量分数是![]() 。
。

练习册系列答案
相关题目