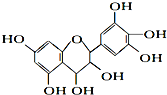
题目内容
【题目】下列事实不能证明甲酸(HCOOH,一元酸)为弱酸的是( )
A.0.1mol/L甲酸的pH为2.3
B.将pH=2的甲酸稀释100倍后,溶液的pH小于4
C.温度升高,溶液的导电能力增强
D.等体积等浓度的甲酸和HCl与足量的锌反应,产生等量的氢气
【答案】D
【解析】
试题分析:0.1mol/L甲酸的pH为2.3,![]() ,说明甲酸没有完全电离,为弱酸,故A错误;将pH=2的甲酸稀释100倍后,溶液的pH小于4,说明加水稀释过程中醋酸电离平衡正向移动,甲酸为弱酸,故B错误;温度升高,溶液的导电能力增强,升高温度过程中醋酸电离平衡正向移动,甲酸为弱酸,故C错误;等体积等浓度的甲酸和HCl的物质的量相同,与足量的锌反应产生等量的氢气,不能证明甲酸为弱酸,故D正确。
,说明甲酸没有完全电离,为弱酸,故A错误;将pH=2的甲酸稀释100倍后,溶液的pH小于4,说明加水稀释过程中醋酸电离平衡正向移动,甲酸为弱酸,故B错误;温度升高,溶液的导电能力增强,升高温度过程中醋酸电离平衡正向移动,甲酸为弱酸,故C错误;等体积等浓度的甲酸和HCl的物质的量相同,与足量的锌反应产生等量的氢气,不能证明甲酸为弱酸,故D正确。

【题目】
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g(31℃)。
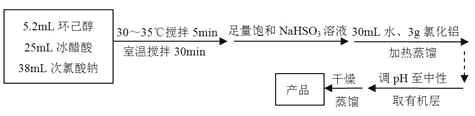
主反应:
回答下列问题:
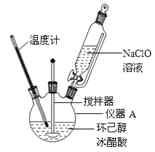
(1)仪器A的名称是 。
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有 、 。
(3)加入饱和NaHSO3溶液时发生的主要反应是 (用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是 。
(4)为将馏出液的pH调至中性,可以加入的试剂是 。
A.稀盐酸 | B.无水碳酸钠 | C.浓硫酸 | D.氢氧化钠固体 |
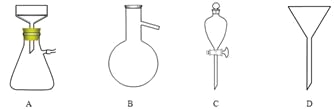
(5)调节pH后还需加入精制食盐,其目的是 ,“取有机层”时使用的主要仪器是 。(填下图对应的字母)。
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究。他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定。具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3==2NaI+Na2S4O6 。则该NaClO溶液的浓度是 。
【题目】
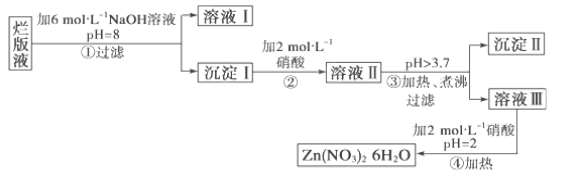
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。