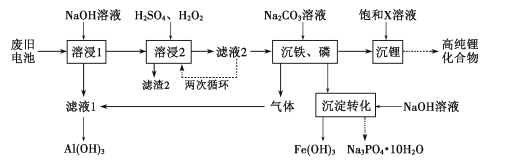
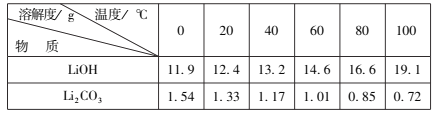
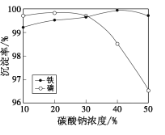
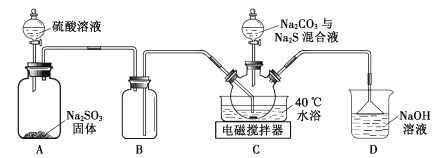
题目内容
【题目】能正确表示下列反应的离子方程式的是
A.向FeBr2溶液中通入过量Cl2:![]()
B.钠与水反应:![]()
C.酸化KIO3和KI的混合溶液:![]()
D.将铜丝插入稀硝酸中:![]()
【答案】B
【解析】
本题考查离子方程式的书写,明确反应实质是解题关键,向FeBr2溶液中通入过量Cl2,氯气不仅可以氧化亚铁离子,还可以与溴离子发生反应;碘酸钾和碘化钾在酸性溶液中会发生归中反应,但题目方程式没有配平;铜与稀硝酸反应生成一氧化氮。
A.过量的Cl2不仅会氧化亚铁离子,还可以和Br-发生反,FeBr2中Fe2+与Br-之比为1:2,所以离子方程式为![]() ,A项错误;
,A项错误;
B. 钠与水反应:![]() ,B项正确;
,B项正确;
C. 酸化KIO3和KI的混合溶液的离子方程式没有配平,正确反应离子方程式为:![]() ,C项错误;
,C项错误;
D. Cu和稀硝酸反应生成NO,所以离子方程式为:![]() ,D项错误。
,D项错误。
答案选B。

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目