题目内容
【题目】I.锰是在地壳中广泛分布的元素之一,其单质和化合物在工农业生产中有着重要的作用。已知Al的燃烧热为ΔH=—ckJ·mol—1,金属锰可用铝热法制得。其余相关热化学方程式为:3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) ΔH1 = akJ·mol—1
3MnO2(s)=Mn3O4(s)+O2(g) ΔH2 = b kJ·mol—1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) ΔH3 =__________kJ·mol—1(用含a、b、c的式子表示)
II.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
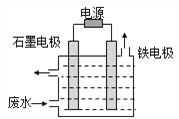
(1)电解处理法:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极”或“阳极”),阳极产生ClO-的电极反应为__________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________。
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH—=4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
①废水中的CN一经以下反应实现转化:CN—+H2O2+H2O=A+NH3↑,则A是__________(用符号表示)。
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为__________(a.7-10;b.10-11;c.11-13),解释该pH不宜太大的原因__________。
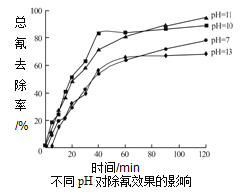
【答案】ΔH=a/3+b — 4/3c kJ·mol-1阴极Cl-+2OH--2e-=ClO-+H2O5ClO—+2CN—+2OH—=2CO32—+N2↑+5Cl—+H2OHCO3—b碱性太强,溶液中4[Fe(CN)6]3-+4OH—===4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去
【解析】I.①3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) ,②3MnO2(s)=Mn3O4(s)+O2(g),③4Al(s)+3O2(g)=2Al2O3(s) △H=-4ckJ·mol-1,(①+3×②+③)/3,得出△H=(a+3b-4c)/3kJ·mol-1; II.(1)依据电解原理,金属作阳极,先失电子,题目中提供信息:阳极产生的是ClO-,因此铁作阴极,阳极是失电子,化合价升高,控制溶液的pH在9-10,说明溶液显碱性,阳极反应式为Cl-+2OH--2e-=ClO-+H2O,ClO-将CN-氧化成无害物质,即Cl转化成Cl-,环境是碱性环境,C转化成CO32-,N转化成N2,ClO-+CN-→CO2↑+N2↑+Cl-,然后根据化合价升降进行配平,5ClO-+2CN-→2CO32-+N2↑+5Cl-,利用电荷守恒和原子守恒,配平其他,写出缺少的微粒,因此离子反应方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;(2)①根据元素守恒、原子守恒、电荷守恒,A应带一个单位的负电荷,A中含有的一个C原子、一个H原子、3个氧原子,因此A为HCO3-,②根据不同pH对除氰效果的影响图,应选择除氰率最高的即pH在10~11,故选项b正确;根据查阅资料①,[Fe(CN)6]4-在碱性条件下更稳定,难以除去,具体回答是:碱性太强,溶液中4[Fe(CN)6]3-+4OH—===4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案